Jus de chou rouge
Les fleurs, les légumes, les fruits et, d'une manière générale, les plantes ayant une couleur (autre que le vert de la chlorophylle) renferment des molécules qui sont responsables de cette couleur. Certaines de ces molécules sont sensibles à leur environnement chimique et leur couleur peut ainsi varier, comme des indicateurs colorés.
C'est le cas des anthocyanines, famille de colorants naturels (les flavonoïdes) dont la couleur varie sur tout le spectre coloré (selon les groupements présents sur le squelette de base) et en fonction du pH de la solution, c'est à dire de son acidité ou, au contraire, de son alcalinité (basicité). On parle alors d'indicateur de pH. Le légume le plus représentatif est certainement le chou rouge.
Nous utilisons le jus de chou rouge pour illustrer la variation de couleur en fonction du pH. On pourrait d'ailleurs s'étonner que ce chou soit appelé rouge, alors qu'il est violet ! Et nous allons voir qu'il peut prendre toutes les couleurs !
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Porter des lunettes de protection et des gants pour manipuler les acides et bases
 . Porter une blouse pour se protéger des acides et bases et aussi pour éviter les taches de jus de chou rouge.
. Porter une blouse pour se protéger des acides et bases et aussi pour éviter les taches de jus de chou rouge. - Ne pas agiter les tubes en bouchant avec un doigt ! Utiliser un petit bouchon adapté au tube.
- Toutes ces solutions peuvent être jetées à l'évier et diluée à l'eau courante, sans risque de pollution.
2 Matériel
- Chou rouge
- Acide chlorhydrique HCl

- Vinaigre d'alcool ou acide éthanoïque

- Jus de citron ou acide citrique
- Hydrogénocarbonate de sodium (bicarbonate de sodium) NaHCO3 (levure chimique utilisée en pâtisserie)
- Ammoniaque (solution aqueuse d'ammociac NH3)


- Hydroxyde de sodium NaOH
 en solution (ou du déboucheur d'évier à la soude caustique)
en solution (ou du déboucheur d'évier à la soude caustique) - Plusieurs pipettes et une dizaine de tubes à essai
3 Protocole expérimental
3.1 Préparation du jus de choux rouge
- Mettre à chauffer 1 L d'eau (si possible distillée) dans une casserolle.
- Couper la moitié d'un chou rouge en plusieurs morceaux et les mettre dans l'eau.
- Lorsque l'eau arrive à ébullition, arrêter de chauffer.
- Retirer les bouts de chou rouge, filtrer la solution à l'aide d'un filtre à café et verser le filtrat dans une bouteille pouvant être fermée hermétiquement.
- Le jus de chou rouge peut être conservé plusieurs mois au réfrigérateur, dans sa bouteille fermée, sans subir de dégradation ni dégager de mauvaise odeur de chou.
3.2 Expériences avec les acides et bases
- Verser environ 5 mL de jus de chou rouge obtenu précédemment dans 9 tubes à essai identiques.
- Diluer de moitié le contenu de chaque tube en ajoutant 5 mL d'eau. La couleur devrait être bleue. (Si ce n'est pas le cas, l'eau utilisée est peut-être légèrement acide ou basique ; ce n'est pas important pour la suite des expériences.)
- Effectuer les tests suivants :
- Tube 1 : ne rien y ajouter ! Il s'agit du tube de la couleur de référence, "neutre", du chou rouge. La couleur est normalement bleue.
- Tube 2 : ajouter une ou deux gouttes de jus de citron et mélanger. La couleur vire au rose-violet.
- Tube 3 : ajouter une ou deux gouttes d'acide éthanoïque
 , ou de vinaigre d'alcool. La couleur vire au rose fuchsia.
, ou de vinaigre d'alcool. La couleur vire au rose fuchsia. - Tube 4 : ajouter une ou deux gouttes d'acide chlorhydrique
 . La couleur vire au rouge.
. La couleur vire au rouge. - Tube 5 : ajouter une dizaine de goutte d'acide chlorhydrique
 . Constater que la couleur reste rouge et n'évolue plus quand on ajoute encore de l'acide.
. Constater que la couleur reste rouge et n'évolue plus quand on ajoute encore de l'acide. - Tube 6 : ajouter une pincée d'hydrogénocarbonate de sodium et agiter. La couleur devient bleu-turquoise.
- Tube 7 : ajouter une goutte d'ammoniaque

 . La couleur devient d'un vert vif.
. La couleur devient d'un vert vif. - Tube 8 : ajouter une goutte d'une solution d'hydroxyde de sodium
 . La couleur devient jaune-vert.
. La couleur devient jaune-vert. - Tube 9 : ajouter plusieurs gouttes d'une solution d'hydroxyde de sodium
 . Constater que la couleur devient jaune vif et n'évolue plus quand on ajoute encore de la soude.
. Constater que la couleur devient jaune vif et n'évolue plus quand on ajoute encore de la soude.
- On peut se demander si les couleurs peuvent être réservibles. Pour cela effectuer les tests suivants :
- Tube 10 : ajouter une ou deux gouttes de vinaigre d'alcool. La couleur devient rose fuchsia.
- Dans ce même tube, ajouter quelques gouttes d'ammoniaque

 et constater que la couleur revient au bleu, puis devient d'un vert vif.
et constater que la couleur revient au bleu, puis devient d'un vert vif. - Toujours dans ce tube, ajouter du vinaigre d'alcool et constater que la couleur peut repasser au bleu, puis au rose.
- Enfin, un test amusant consiste à souffler avec une paille dans un récipient contenant du jus de chou rouge, de manière à faire des bulles. Après quelques expirations, la couleur initialement bleue ou violette vire vers le rose (explications ci-après).
4 Explications
- Le pH est lié à la concentration[1] en ions H3O+ (ion hydroxonium) présents dans une solution (notée [H3O+], mol/L), par la relation :
- pH = –Log [H3O+]
- dans laquelle Log est le logarithme décimal. Par exemple, :
- [H3O+] = 10–3 mol/L équivaut à pH = 3 (acide),
- [H3O+] = 10–8 mol/L équivaut à pH = 8 (basique).
- Et on dit que :
- un pH = 7 est celui d'une solution neutre (à 25°C),
- un pH < 7 est dit acide,
- un pH > 7 est dit basique.
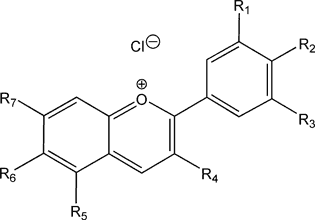
- Les anthocyanines (ou anthocyanes) sont des molécules sensibles à la présence des ions H3O+ et HO–, et par conséquent à la valeur du pH de la solution dans laquelle elles se trouvent. Les groupements R1 à R7 varient en fonction des molécules de cette famille et des plantes. Ils jouent le rôle de chromophores, c'est à dire de groupements qui modifient la couleur de la molécule de base. Ce sont des molécules aux propriétés antioxydantes (comme la vitamine C, ou les polyphénols), protectrices des ultraviolets et du dioxygène. On les utilise aussi comme colorants alimentaires (codes E163x). Pour les anthocyanines, le substituant R3 est un glycosyle (glucose substitué). Voici quelques molécules de la famille des anthocyanidines dans lesquelles le groupement glucosyle a été remplacé par un substituant[2][3] :
| Anthocyanidine | R1 | R2 | R3 | R4 | R5 | R6 | R7 | Code E | Présence dans |
|---|---|---|---|---|---|---|---|---|---|
| Aurantinidine | -H | -OH | -H | -OH | -OH | -OH | -OH | Lys | |
| Cyanidine | -OH | -OH | -H | -OH | -OH | -H | -OH | E163a | Chou rouge, fraise, airelle, mûre, mûroise, framboise, cerise, canneberge, pomme, sureau, aubépine |
| Delphinidine | -OH | -OH | -OH | -OH | -OH | -H | -OH | E163b | Airelle, myrtille, grenade, violette, pensée, dauphinelle |
| Europinidine | -OCH3 | -OH | -OH | -OH | -OCH3 | -H | -OH | ||
| Lutéolinidine | -OH | -OH | -H | -H | -OH | -H | -OH | ||
| Pélargonidine | -H | -OH | -H | -OH | -OH | -H | -OH | E163d | Fraise, pélargonium (géranium), framboise, myrtille, mûre, prune, canneberge, grenade |
| Malvidine | -OCH3 | -OH | -OCH3 | -OH | -OH | -H | -OH | E163c | Myrtille, raisin vitis vinifera, vin rouge, primevère |
| Péonidine | -OCH3 | -OH | -H | -OH | -OH | -H | -OH | E163e | Airelle, volubilis, canneberge, myrtille, prune, raisin, cerise, riz noir, banane noire |
| Pétunidine | -OCH3 | -OH | -OH | -OH | -OH | -H | -OH | E163f | Myrtille, aronia, amélanchier à feuilles d'aulne, muscadine (genre de vigne), et nombreuses fleurs... |
| Rosinidine | -OCH3 | -OH | -H | -OH | -OH | -H | -OCH3 | Catharanthus roseus |
- Une plante peut contenir un ou plusieurs types d'anthocyanines, en plus ou moins grandes quantités, ce qui fait que la variation de jus de plantes différentes en fonction du pH peut donner des couleurs différentes.
- Avec le jus de chou rouge, il est possible de fabriquer une échelle de couleur très variée en fonction du pH, mesuré par exemple avec un pH-mètre. On peut ainsi utiliser un produit naturel et à bas prix pour quelques analyses élémentaires de pH.
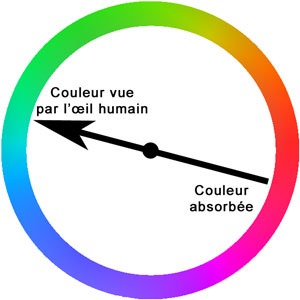
- La couleur vue par notre oeil est en réalité celle qui n'est pas absorbée par la molécule lorsqu'elle est éclairée par une lumière blanche (lumière du soleil), c'est à dire la couleur complémentaire. Si la molécule absorbe majoritairement la couleur rouge, notre oeil verra la couleur complémentaire : le vert.
- La couleur absorbée par une molécule dépend de la différence d'énergie qui existe entre l'état fondamental (de plus basse énergie) et les premiers états excités. En fonction du pH, la répartition des électrons dans la molécule est modfiée, ce qui implique une modification d'énergie des états, fondamental et excités, de la molécule. (La compréhension de ces notions fait appel à la mécanique quantique.)
- Dans une certaine gamme de pH, la passage de la molécule d'une forme à une autre est réversible, ce qui explique pourquoi on peut revenir à la couleur initiale en ajoutant un produit d'acidité contraire. Par contre si le pH est trop basique (couleur jaune), la structure de la molécule est modifiée (réaction chimique) et la réversibilité n'est plus possible.
- Le test avec les acides et bases utilisées ci-dessus permet de conclure :
- Que le jus de citron (acide citrique) est moins acide que le vinaigre (acide éthanoïque), lui même bien moins acide que l'acide chlorhydrique. En effet les acides contenus dans les jus d'agrumes ou le vinagre sont des acides faibles ; l'acide chlorhydrique est un acide fort.
- Que l'hydrogénocarbonate de sodium est une base plus faible que l'ammoniaque, elle-même plus faible que la soude caustique. Le deux premières sont des bases faibles ; la soude caustique (hydroxyde de sodium) est une base forte.
Il est alors possible de tester d'autres solutions aqueuses pour connaître leur pH : eau distillée, eau de mer, eau de piscine, eau gazeuse, eau savoneuse, eau de Javel, salive, urine, larmes, produit anti-calcaire... (à condition que ces solutions ne soient pas trop colorées elles-mêmes.)
Mais alors, que se passe-t-il pour le changement de couleur observé lorsque l'on souffle dans le jus avec une paille ? La raison est que l'air expiré de nos poumons s'est chargé en gaz carbonique (ou dioxyde de carbone CO2) : c'est un gaz qui possède un caractère faiblement acide dans l'eau.
- À titre de comparaison, ces mêmes tests peuvent être réalisés :
- Sur du jus de framboise, obtenu en broyant des framboises dans un bol puis en filtrant le jus. La couleur de la framboise "normale" devient d'un vert vif en milieu très basique.
- Sur du jus de betterave rouge, obtenu en faisant cuire une betterave coupée en morceaux dans de l'eau. La couleur violette devient rouge puis jaune en milieu franchement acide.
- Sur d'autres fruits ou légumes : cassis, cerise, groseille, mûre, myrtille, fraise, raisin rouge, fleurs bleues, fleurs roses...
5 En savoir plus
- Il existe un grand nombre de molécules dont la couleur varie avec le pH : voir une liste des indicateurs colorés de pH. Il suffit en fait que les énergies des niveaux électroniques dans une telle molécule varient avec la répartition des électrons dans la molécule ; c'est souvent le cas lorsqu'une molécule possède des insaturations conjuguées entre elles et avec des groupements chimiques donneurs ou accepteurs d'ions H3O+ ou d'ions HO–.
- Les molécules d'indicateurs colorés sont elles-mêmes des acides ou bases faibles. Il ne faut donc pas en mettre beaucoup dans la solution à tester car elles réagissent aussi et pourrait fausser les mesures. 2 ou 3 gouttes dans 10 mL de solution à tester suffisent généralement pour obtenir une teinte visible.
6 Références
- Aller ↑ En toute rigueur, le pH est lié à l'activité et non la concentration, ce qui revient au même pour des solutions diluées.
- Aller ↑ http://en.wikipedia.org/wiki/Anthocyanin (en)
- Aller ↑ Journal of Chemical Education, avril 1996, p. 306-309