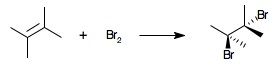Analyse organique fonctionnelle
| Cette page fait partie des articles à compléter et n'est pas validée. Considérez-la comme une ébauche. | |
| Si vous relevez des erreurs, merci de les signaler sur la page de discussion ou les corriger directement. | |
| Pour contribuer au wiki, prenez connaissances du protocole de contribution et des règles de contribution, identifiez-vous et prenez modèle sur d'autres pages du wiki. |
L'analyse organique fonctionnelle consiste en l'analyse d'un composé organique par l'observation de la réactivité chimique des fonctions présentes.
Sommaire
[masquer]- 1 Principe
- 2 Remarques
- 3 Démarche
- 4 Tests qualitatifs
- 4.1 Test de Belstein
- 4.2 Test au dibrome
- 4.3 Réaction de Bayer
- 4.4 Test des aromatiques
- 4.5 Test à la 2,4-DNPH
- 4.6 Réaction iodoforme
- 4.7 Test au chlorure de fer (III)
- 4.8 Test de Rojahn
- 4.9 Réaction du nitrate de cérium
- 4.10 Test au réactif de Lucas
- 4.11 Test au réactif de Fehling
- 4.12 Test au réactif de Tollens
- 4.13 Test au réactif de Schiff
- 4.14 Test au réactif de Jones
- 4.15 Test au chlorhydrate d'hydroxylamine
- 4.16 Réaction de Libermann
- 4.17 Test de Hinsberg
- 4.18 Test au réactif de Feigl et Okuma
- 4.19 Réactif à la ninhydrine
- 5 Résumé des réactivités
- 6 Cas pratiques, exemples
- 7 Références
1 Principe
Ces analyses se déroulent en 3 étapes, quand on est confronté à un composé inconnu. La première étape consiste en l'observation de l'aspect de la substance, de sa réactivité vis à vis de la combustion, et de la détermination de la solubilité de cette molécule dans divers solvants voire de ses propriétés acidobasiques. La seconde étape consiste en des tests caractéristiques de certaines fonctions organiques, permettant d'orienter l'analyse vers d'autres tests, eux spécifiques d'une fonction en particulier. La troisième étape consiste alors à faire des essais (dits de confirmation) qui permettront de déterminer quels sont les groupements en présence dans notre molécule.
- Avantages : mis bout à bout, ces tests permettent d'appréhender la réactivité de certaines molécules, d'expliquer pourquoi elles réagissent, et permettent d'effectuer de l'analyse qualitative avec des moyens relativement rudimentaires, mais efficaces quand on sait vers ou se diriger.
- Inconvénients, limites : l'analyse organique fonctionnelle est relativement désuète actuellement à l'ère des spectromètres RMN et de l'analyse par spectrométrie de masse couplée à d'autres techniques de séparation, en outre le composé utilisé ne doit pas comporter beaucoup (supérieur à 4) de groupements fonctionnels différents, et il ne doit pas être en mélange avec d'autres composés, car les analyses seraient alors faussées.
Dans toute la suite des évènements, on s'efforcera d'avoir des composés plus ou moins purifiés, et de préférence isolés et non sous forme de mélanges. L'analyse organique fonctionnelle est très utile quand on cherche à déterminer la bonne marche d'une réaction, et l'obtention des composés voulus lors de certaines synthèses, pour peu de savoir vers où on doit se diriger.
2 Remarques
Les progrès techniques ont permis de développer des appareils permettant d'effectuer l'analyse structurale et fonctionnelle après séparation quantitative des différents constituants d'un mélange, méthodes parmi lesquelles peuvent être rencontrées l'analyse spectrale type spectroscopie infrarouge (IR), ultraviolet-visible (UV-vis), la spectroscopie par résonance magnétique nucléaire (RMN), ou encore l'analyse élémentaire, on se limitera ici à présenter une liste exhaustive de tests simples permettant de procéder à ces analyses fonctionnelles de manière simple telle que les chimistes les avaient développées avant l'émergence des techniques assistées par appareils. Il s'agit ici de présenter des essais simples permettant de se faire une idée du composé que l'on a en face de soi, il ne s'agit nullement de techniques permettant d'identifier en profondeur la structure d'une molécule inconnue.
3 Démarche
3.1 1re étape
Observations :
- Aspect de la substance étudiée (état physique, odeur, couleur)
- Réaction au feu (combustible ou non)
- Solubilité dans divers solvants (eau, hydroxyde de sodium dilué, acide chlorhydrique dilué, acide sulfurique concentré, éther éthylique)
- Réactions acidobasiques (éventuellement, avec NaOHaq, HClaq)
3.2 2e étape
Ensuite, il s'agit de procéder à des tests caractéristiques de certaines fonctions organiques, tests qui permettront d'orienter l'analyse.
3.3 3e étape
Enfin, il s'agit de procéder à des tests spécifiques d'une fonction organique en particulier, autant de tests spécifiques que l'on aura de fonctions différentes dans notre composé, qui permettront enfin de déterminer avec certitude les fonctions contenues dans la molécule étudiée. D'où l'intérêt d'avoir des composés relativement peu polyfonctionnels...
4 Tests qualitatifs
4.1 Test de Belstein
Il s'agit ici de déterminer si le composé étudié contient des halogènes, il consiste en faire passer un fil de cuivre (préalablement trempé dans le composé étudié) dans la flamme oxydante d'un bec Bunsen (ou Meker), si la flamme se colore en bleu-vert (par la formation d'un halogénure de cuivre), le composé étudié contient un halogène tel que le brome (Br), le chlore (Cl) ou encore l'iode (I). Il ne s'agit toutefois pas d'un test spécifique car une telle coloration de flamme peut se présenter en cas de présence d'impuretés.
- Variante : en faisant aspirer les vapeurs d'un solvant organique au bec a gaz tout en mettant le fil de cuivre dans la flamme on observera la coloration verte ou bleue s'il contient chlore, brome ou iode. Cette méthode est plus sensible
- Explication : dans ces conditions, il se forme un peu d'halogénure de cuivre volatile et c'est le cuivre qui colore la flamme. Dans le cas de produits contenant du cuivre (et combustible) on observe cette teinte bleue : faire l'essai en brûlant un papier imprimé en bleu (qui contient souvent des phtalocyanines).
4.2 Test au dibrome
Ce test permet de rechercher une insaturation présente dans une molécule organique, il donne également lieu à des substitutions électrophiles sur les cycles aromatiques à chaud et à des réactions type haloforme sur les cétones méthylées. Il n'est donc pas spécifique.
Le réactif est préparé par dilution de 13 g de dibrome ![]()
![]()
![]() pour 100 g de chloroforme
pour 100 g de chloroforme ![]()
![]() .
.
Introduire dans un tube à essais le composé étudié et le dissoudre dans 2 mL de chloroforme, et ajouter goutte-à-goutte le réactif précédemment préparé, agiter manuellement. Plusieurs observations peuvent se présenter :
- Décoloration à froid, sans dégagement gazeux : présence de liaisons doubles (ou triples) carbone-carbone.
- Décoloration à froid, avec dégagement gazeux faisant virer le papier pH au rouge : présence d'un cycle aromatique (type phénol ou amines aromatiques), il s'agit d'une réaction de substitution électrophile qui produit du HBr gazeux.
- Décoloration à chaud (bain marie) : présence d'un hydrocarbure aromatique, ou il se produit une substitution radicalaire sur la chaine latérale, et éventuellement une substitution électrophile du cycle aromatique.
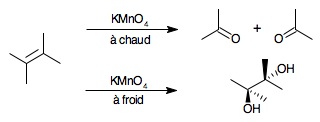
4.3 Réaction de Bayer
Ce test permet de rechercher une insaturation présente dans une molécule organique, il donne également lieu à des réactions d'oxydation avec des molécules présentant des groupements facilement oxydables (aldéhydes, alcools, certaines amines).
Le réactif est une solution aqueuse de permanganate de potassium ![]()
![]()
![]() à 2% dans l'eau.
à 2% dans l'eau.
Introduire dans un tube à essais le composé étudié et le dissoudre dans 2 mL d'eau, ou d'acétone ![]() , et ajouter 3 gouttes du réactif (pas plus). Plusieurs cas peuvent alors se présenter :
, et ajouter 3 gouttes du réactif (pas plus). Plusieurs cas peuvent alors se présenter :
- Décoloration à froid : présence de liaisons doubles (ou triples) carbone-carbone, ou décoloration après plusieurs minutes : présence d'un groupement facilement oxydable : alcool, phénol, aldéhyde, cétone,...
- Décoloration à chaud : présence d'un hydrocarbure aromatique possédant une chaîne latérale, il s'agit ici encore d'une oxydation.
- Apparition d'une coloration brune : réaction positive comme indiquée ci dessus.
4.4 Test des aromatiques
Ce test est spécifique des composés aromatiques, il s'agit d'une réaction type Friedel-Crafts du chloroforme sur le cycle aromatique en présence de chlorure d'aluminium anhydre sublimé qui conduit à un complexe coloré.
Le réactif est le chloroforme, on utilise le chlorure d'aluminium anhydre comme catalyseur que l'on sublime sur les parois d'un tube à essais, et on verse par dessus une solution du composé dans le chloroforme anhydre, on observe une coloration.
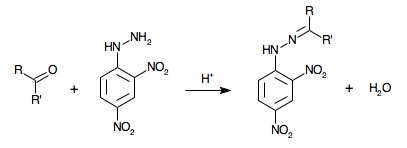
[[Image:|frame|center|Équation relative à l'action]]4.5 Test à la 2,4-DNPH
- Voir aussi : 2,4-dinitrophénylhydrazine


4.6 Réaction iodoforme
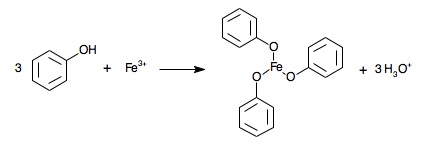
[[Image:|frame|center|Équation relative à l'action]]4.7 Test au chlorure de fer (III)
Ce test est spécifique des phénols, et dérivés, qui donnent des colorations variant du bleu au violet en présence d'une solution aqueuse de chlorure de fer (III) ![]() .
.
Ce réactif est préparé à partir 3,3 g de chlorure de fer (III) hexahydraté ![]() (FeCl3•6H2O) dissous dans 100 mL d'eau distillée.
(FeCl3•6H2O) dissous dans 100 mL d'eau distillée.
On observe les teintes suivantes selon les dérivés utilisés :
| Teinte | Dérivé |
|---|---|
| Bleue | Phénol, crésols (o-, m-, p-méthylphénol) |
| Bleu foncé | Morphine |
| Bleu violacé | Résorcinol (benzène-1,3-diol), phloroglucinol (benzène-1,3,5-triol) |
| Violet | Acide salicylique |
| Jaune-vert foncé | paracétamol |
| Vert | Adrénaline |
| Précipité vert foncé | Hydroquinone (benzène-1,4-diol) |
| Jaune puis brun par oxydation | Pyrogallol |
| Bleu puis noir par oxydation | Pyrogallol |
4.8 Test de Rojahn
[[Image:|frame|center|Équation relative à l'action ]]4.9 Réaction du nitrate de cérium
[[Image:|frame|center|Équation relative à l'action ]]4.10 Test au réactif de Lucas
[[Image:|frame|center|Équation relative à l'action ]]4.11 Test au réactif de Fehling
- Préparation et utilisation : voir Réactif de Fehling
4.12 Test au réactif de Tollens
- Préparation et utilisation : voir Réactif de Tollens
4.13 Test au réactif de Schiff
[[Image:|frame|center|Équation relative à l'action ]]4.14 Test au réactif de Jones
Également nommé réactif de Bordwell-Wellmann, il s'agit d'anhydride chromique dissout dans de l'acide sulfurique concentré. Il donne le même type de réactions que le permanganate de potassium à chaud.
[[Image:|frame|center|Équation relative à l'action ]]4.15 Test au chlorhydrate d'hydroxylamine
[[Image:|frame|center|Équation relative à l'action ]]4.16 Réaction de Libermann
[[Image:|frame|center|Équation relative à l'action ]]4.17 Test de Hinsberg
[[Image:|frame|center|Équation relative à l'action ]]4.18 Test au réactif de Feigl et Okuma
[[Image:|frame|center|Équation relative à l'action ]]4.19 Réactif à la ninhydrine
[[Image:|frame|center|Équation relative à l'action]]5 Résumé des réactivités
5.1 Alcanes
- Pratiquement inertes chimiquement.
- Insolubles dans l'eau et dans l'acide sulfurique concentré.
- Combustibles.
5.2 Alcènes
- Insolubles dans l'eau, solubles dans l'acide sulfurique concentré, avec réaction exothermique.
- Décolorent, à froid, le dibrome en solution dans le chloroforme.
- Décolorent, à froid, le permanganate de potassium en solution aqueuse.
5.3 Aromatiques
- Insolubles dans l'eau, insolubles dans l'acide sulfurique concentré, sauf quelques polyalkylés.
- Décolorent, à chaud uniquement, le dibrome en solution dans le chloroforme.
- Décolorent, à chaud uniquement, le permanganate de potassium en solution aqueuse (présence d'une chaîne latérale).
- Donnent des réactions colorées lors des réactions type Friedel-Crafts.
- Sont susceptibles d'être nitrés (réaction du mélange sulfonitrique acide) et donnent un précipité ou une huile à odeur d'amandes.
5.4 Halogénures d'alkyle
- Insolubles dans l'eau, insolubles dans l'acide sulfurique concentré.
- Coloration verte de la flamme lors du test de Belstein.
- Donnent un précipité insoluble dans l'acide nitrique concentré par addition de nitrate d'argent en solution alcoolique.
- Donnent un précipité par addition de iodure de sodium en solution dans l'acétone.
5.5 Alcools
- Solubles dans l'eau pour les termes à basse masse molaire, insolubles dans l'éther pour les polyols, insolubles dans l'eau mais solubles dans l'acide sulfurique concentré pour les termes à haute masse molaire.
- Décolorent le permanganate de potassium en solution aqueuse, parfois à froid, le plus souvent à chaud.
- Donnent une coloration rouge avec le nitrate de cérium ammoniacal.
- Réduisent le réactif de Bordwell-Wellmann.
- Réactivité particulière des alcools primaires : donnent lieu à une réaction négative avec le réactif de Lucas.
- Réactivité particulière des alcools secondaires : donnent lieu à une opalescence lente avec le réactif de Lucas.
- Réactivité particulière des alcools tertiaires : réaction spontanée avec l'acide chlorhydrique concentré qui dépose des chlorures tertiaires qui se séparent.
5.6 Phénols
- Peu solubles dans l'eau, solubles dans l'hydroxyde de sodium en solution aqueuse et insolubles en solution acide.
- Donnent une réaction colorée en présence de chlorure de fer (III).
- Décolorent le dibrome en solution dans le chloroforme en dégageant du bromure d'hydrogène gazeux (papier pH).
- Décolorent le permanganate de potassium en solution aqueuse.
- Donnent deux virages de couleur lors de la réaction de Libermann.
- Donnent lieu à des réactions de couplage diazoïque avec l'acide sulfanilique en présence d'acide nitreux.
5.7 Composés carbonylés
- Donnent lieu un précipité jaune/orange avec la 2,4-DNPH en solution aqueuse acidifée.
- Donnent lieu à une coloration rouge en présence de chlorhydrate d'hydroxylamine en solution aqueuse acidifiée (à pH = 3,7) en présence d'un indicateur universel.
On distingue les aldéhydes des cétones par les critères suivants :
- Réactions spécifiques aux aldéhydes :
- Décoloration du permanganate de potassium en solution aqueuse
- Réduisent le réactif de Bordwell-Wellmann
- Réduisent la liqueur de Fehling
- Donnent une réaction positive au réactif de Schiff.
- Produisent l'apparition d'un miroir d'argent avec le réactif de Tollens.
- Donnent lieu à la formation d'un composé bisulfitique soluble dans l'eau en présence d'hydrogénosulfite de sodium.
- Réactions spécifiques aux cétones :
- Il n'y a globalement pas de réactions spécifiques des cétones, elles se remarquent par le précipité de 2,4-DNPhydrazone et l'absence de réactions positives lors des tests spécifiques aux aldéhydes.
- Exception : les cétones méthylées donnent lieu à la formation d'un précipité d'iodoforme lors de l'addition d'une solution aqueuse de diiode dans le iodure de potassium à une solution basique du composé étudié.
5.8 Acides carboxyliques
- Donnent lieu à une réaction acide au papier pH.
- Solubles dans l'hydroxyde de sodium en solution diluée, solubles dans l'hydrogénocarbonate de sodium en solution diluée avec dégagement de dioxyde de carbone gazeux.
- Précipitent sous forme de carboxylates d'argent, de baryum ou de plomb lors de l'ajout de solutions des métaux correspondants en milieu basique.
- Forment des esters odorants avec l'éthanol à chaud, par catalyse à l'acide sulfurique.
5.9 Esters
- Généralement insolubles dans l'eau mais solubles dans l'acide sulfurique concentré, et dans l'éther éthylique.
- Généralement, ils sont reconnaissables à leur odeur fruitée, du moins souvent agréable.
- Donnent une réaction positive lors du test de Rojahn.
- Forment de l'acide hydroxamique en présence d'hydroxylamine et de chlorure de fer (III) dans l'éthanol et l'acide chlorhydrique dilué (réaction non spécifique).
5.10 Amines linéaires
- Dissoudre 3 g de thiocyanate d'ammonium
 et 1 g de chlorure de cobalt
et 1 g de chlorure de cobalt 

 dans 20 mL d'eau.
dans 20 mL d'eau.
Note :
- Les amines et les alcaloïdes passent du bleu à une couleur pâle en 2h.
- Les amines réagissent avec la ninhydrine en présence d'acide acétique avec de l'éthanol en guise de solvant.
- Les amines et les alcaloïdes réagissent en présence d'acide nitrique à 65% dans 100 mL d'éthanol.
- La présence est révélée avec une lampe à ultraviolets, après chauffage prolongé vers 120°C.
5.11 Acides aminés
- Donnent une réaction avec la ninhydrine.
6 Cas pratiques, exemples
White spirit, éthanol, dichlorométhane, acétone, essence C...
7 Références
- Fascicule de travaux pratiques de chimie organique, classes de première et terminale STL chimie.
- Fascicule de travaux pratiques de chimie organique, première année de DUT chimie, deuxième module.
- J.Mesplède et C.Saluzzo, "100 manipulations de chimie organique et inorganique - CAPES et agrégation de sciences physiques" - Éditions Bréal - ISBN : 2 7495 0352 3
- M.Blanchard-Desce, "Chimie organique expérimentale" - Éditions Hermann, éditeur des arts et des sciences - ISBN : 2 7056 6063 1
- A.Vogel - Practical Organic Chemistry, 3e édition