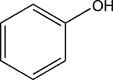
Phénol
Un article du site scienceamusante.net.

|
| GHS06 |

|
| GHS08 |
|
| GHS05 |
- Formule brute : C6H6O
- Formule semi-développée : C6H5-OH
- Autre dénomination : hydroxybenzène, alcool phénylique, acide carbolique
- N°CAS : 108-95-2
- N°CE : 203-632-7
Sommaire
[masquer]1 Propriétés physiques[1]
- Masse molaire : 94,11 g/mol
- Température de fusion : 40,89°C
- Température d'ébullition : 181,87°C
- Densité : 1,071 (25°C) ; 1,045 (45°C)
- Solubilité :
- Eau, éthanol : soluble
- Éther diéthylique : très soluble
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
2.1 C ≥ 3%
- Mutagénicité sur les cellules germinales, catégorie 2
- Toxicité aiguë par voie orale, catégorie 3
- Toxicité aiguë par voie cutanée, catégorie 3
- Toxicité aiguë par inhalation, catégorie 3
- Toxicité spécifique pour certains organes cibles - Exposition répétée, catégorie 2
- Corrosion cutanée/irritation cutanée, catégorie 1B
![]()
![]()
![]() Danger
Danger
- H341 : Susceptible d’induire des anomalies génétiques.
- H301+H311+H331 : Toxique par ingestion, par contact cutané ou par inhalation.
- H373 : Risque présumé d’effets graves pour les organes à la suite d’expositions répétées ou d’une exposition prolongée.
- H314 : Provoque de graves brûlures de la peau et de graves lésions des yeux.
| Voir / adapter / imprimer cette étiquette |
2.2 1% ≤ C < 3%
- Mutagénicité sur les cellules germinales, catégorie 2
- Toxicité aiguë par voie orale, catégorie 3
- Toxicité aiguë par voie cutanée, catégorie 3
- Toxicité aiguë par inhalation, catégorie 3
- Toxicité spécifique pour certains organes cibles - Exposition répétée, catégorie 2
- Corrosion cutanée/irritation cutanée, catégorie 2
- Lésions oculaires graves/irritation oculaire, catégorie 2
![]()
![]()
![]() Danger
Danger
- H341 : Susceptible d’induire des anomalies génétiques.
- H301+H311+H331 : Toxique par ingestion, par contact cutané ou par inhalation.
- H373 : Risque présumé d’effets graves pour les organes à la suite d’expositions répétées ou d’une exposition prolongée.
- H315 : Provoque une irritation cutanée.
- H319 : Provoque une sévère irritation des yeux.
| Voir / adapter / imprimer cette étiquette |
3 Synthèse
Voir : Phénol/synthèse
4 Utilisations et remarques
- Le phénol est utilisé en tant que réactif en chimie organique (particulièrement réactif pour les substitutions électrophiles aromatiques).
- Le phénol a été utilisé en tant qu'antiseptique (notamment en bains de bouche). Le phénol agit sur les membranes cellulaires des bactéries.
- Conservé en flacon bouché (mais pas sous atmosphère inerte) à température ambiante, le phénol réagit sur lui-même par réactions radicalaires avec formation de divers produits colorés qu'il est difficile d'éliminer. Idéalement, le phénol doit être conservé sous atmosphère inerte, à l'abri de la lumière et à une température de 4°C.
5 Où s'en procurer ?
- Auprès des vendeurs de matériel et produits spécialisés
6 Références
- Aller ↑ CRC Handbook of Chemistry and Physics, David R. Lide, 88th edition (2007-2008). ISBN 978-0-8493-0488-0