Vingt démonstrations faciles à faire en classe
Par Maurice Cosandey, Président de l'Association suisse des Olympiades de chimie, École Polytechnique Fédérale de Lausanne (Suisse)
E-mail : maurice.cosandey AT bluewin.ch
Sommaire
[masquer]- 1 Précautions
- 2 Neutralisations acides-bases, en milieu très dilué
- 3 Neutralisation NaOH solide + HCl concentré
- 4 Neutralisation en phase gazeuse NH3 + HCl
- 5 Transferts de proton de H2SO4 à NaCl, puis à H2O
- 6 Coloration de flamme
- 7 Flamme du bec Bunsen
- 8 Combustion de l'essence
- 9 Principe du moteur à explosion
- 10 Combustion de métaux
- 11 Inflammation de la poudre noire
- 12 Fusée au chlorate
- 13 Le nounours grognon
- 14 Manipulation de SO2 sans être gêné par l'odeur
- 15 Circuits imprimés et équations redox
- 16 Illustration analogique de l'équilibre chimique
- 17 Équilibre chimique
- 18 Fabrication de savon
- 19 Étirement du polyéthylène
- 20 Pouvoir rotatoire
- 21 Auto-inflammation spontanée à froid
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Ne réaliser ces expériences qu'avec l'aide d'un professeur de chimie.
- Porter une blouse de chimie en coton, des gants, et travailler sous hotte aspirante.
- Consulter les fiches de sécurité des produits utilisés.
2 Neutralisations acides-bases, en milieu très dilué
2.1 Neutralisation NaOH-HCl, donc sans effet tampon
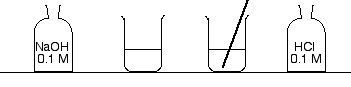
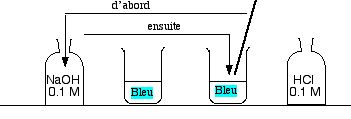
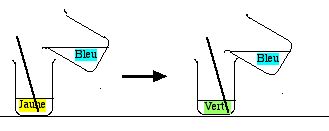
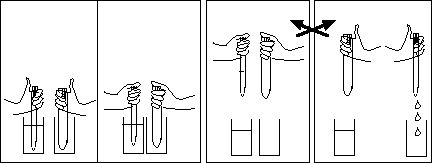
- Remplir à demi deux béchers de 250 mL avec de l'eau distillée.
- Mettre une baguette de verre dans l'un d'entre eux.
- Encadrer ces béchers par deux flacons d'acide chlorhydrique HCl
 à 0,1 mol/L ou 0,2 mol/L, et d'hydroxyde de sodium NaOH
à 0,1 mol/L ou 0,2 mol/L, et d'hydroxyde de sodium NaOH  de même concentration. Ouvrir les flacons.
de même concentration. Ouvrir les flacons.
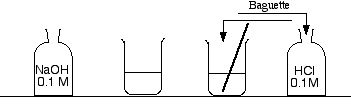
- Tremper la baguette dans le flacon d'acide, et la ressortir. Il reste une ou deux gouttes d'acide sur la baguette. Remettre la baguette dans le bécher d'où elle venait.
- Répéter la même opération avec l'autre bécher et la solution de NaOH.
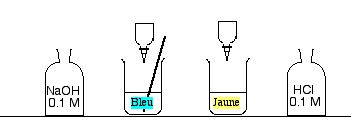
- Verser une goutte de bleu de bromothymol dans chaque bécher. L'eau de gauche devient bleue et jaune à droite.
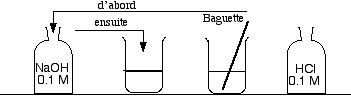
- Tremper la baguette de verre dans le flacon de NaOH, puis l'amener dans le bécher acide (jaune). La solution jaune devient bleue (il faut parfois répéter un deuxième apport).
- Répéter l'opération en plongeant la baguette dans le flacon de HCl, puis dans l'un des béchers bleus,qui devient jaune. Répéter ce mouvement si le bleu reste.
- On peut répéter ce va-et-vient autant de fois que l'on veut.
2.2 Difficile recherche de la neutralité
On peut répéter le petit jeu précédent indéfiniment. On n'arrive jamais au vert de la neutralité, à moins d'une chance extraordinaire...
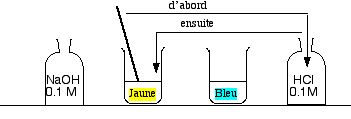
Essayons d'y parvenir autrement. Vider la moitié de l'eau acide.
Verser peu à peu l'eau basique (bleue) dans le reste d'eau acide, on parvient à atteindre le vert, avec de la chance. La solution est alors neutre.
.2.3 Absence de pouvoir tampon
Verser quelques mL de trop : la solution devient bleue
Conclusion : la couleur de la solution est très sensible au moindre excès de base ou d'acide. On dit que la solution n'a aucun “pouvoir tampon”. Énoncer qu'il y a des cas où l'eau “résiste” à l'adjonction d'acide et de base, et qu'on va le montrer avec l'eau du robinet.
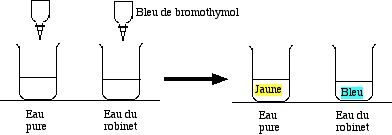
2.4 Impuretés de l'eau pure et de l'eau du robinet
Remplir à demi deux béchers de 250 mL, l'un avec de l'eau distillée, l'autre avec de l'eau du robinet, un peu calcaire. Verser deux gouttes de bleu de bromothymol dans chaque solution. L'une est jaune, acide : l'eau pure. L'autre est bleue, basique : l'eau du robinet
Question à l'auditoire : Quelle est l'impureté de chaque sorte d'eau ?
Expliquer que :
- le gaz carbonique CO2 de l'air se dissout légèrement en formant un acide : H2CO3 (qui n'est pas isolable en réalité)
- le calcaire dissous dans l'eau du robinet forme une base : l'ion hydrogénocarbonate HCO3–
Selon le niveau des élèves, on peut aussi “mentir” et dire que la base est Ca(OH)2.
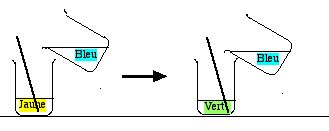
2.5 Pouvoir tampon du calcaire
Prendre les deux béchers du paragraphe précédent et verser lentement l'eau du robinet dans l'eau distillée. Quand on a versé le 20% à 25%, le mélange est vert.
Mais faire observer que ce mélange est “résistant” à l'adjonction de base. Il reste vert si on verse davantage de l'eau du robinet bleue.
Expliquer que : La position de la zone verte n'est pas très sensible à la quantité de base ajoutée, ce qui est très différent de ce qu'on a vu avec HCl et NaOH.
Mieux : Répéter toutes les opérations du § 1.1. en utilisant de l'eau du robinet, et non de l'eau distillée. Une fois verte, la solution reste verte, même si on ajoute une ou deux gouttes d'acide ou de base. Ceci montre que le calcaire a un bon pouvoir tampon.
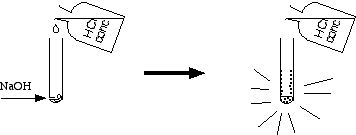
3 Neutralisation NaOH solide + HCl concentré
Attention ! Prudence ! Cette réaction est très vive ! Se protéger le visage et les mains ; si possible, manipuler derrière un écran de protection.
- Introduire quelques grains d'hydroxyde de sodium NaOH solide
 au fond d'un gros tube à essais (d'au moins 15 cm de longueur), tenir le tube avec une pince en bois.
au fond d'un gros tube à essais (d'au moins 15 cm de longueur), tenir le tube avec une pince en bois. - Ouvrir un flacon d'acide chlorhydrique HCl concentré
 . Verser une goutte, maximum deux ! Quand la goutte atteint les grains NaOH, la réaction démarre et produit un bruit de pneu crevé.
. Verser une goutte, maximum deux ! Quand la goutte atteint les grains NaOH, la réaction démarre et produit un bruit de pneu crevé. - Rajouter une autre goutte, puis une autre : le même phénomène se produit.
- Mais très vite, le tube s'échauffe, poser le tube sur un support.
- Continuer d'ajouter l'acide chlorhydrique goutte à goutte, en agitant. Même bruissement à chaque goutte !
- Mais tout-à-coup le bruissement cesse : la réaction est terminée.
- Demander à l'auditoire la nature des grains blancs résiduels.
- Montrer que c'est du sel en remplissant le tube d'eau : les grains disparaissent !
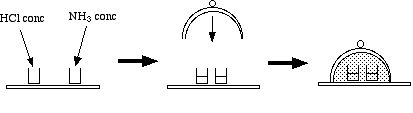
4 Neutralisation en phase gazeuse NH3 + HCl
- Se procurer une cloche de verre étanche (et pas un bécher retourné) et une plaque de verre un peu plus grande que la cloche, plus deux petits béchers (50 mL).
- Remplir à moitié le premier petit bécher avec de l'acide chlorhydrique concentré
 , et le second avec de l'ammoniaque concentrée
, et le second avec de l'ammoniaque concentrée 
 . Mais faire vite, à cause de l'odeur, ou travailler sous hotte aspirante.
. Mais faire vite, à cause de l'odeur, ou travailler sous hotte aspirante. - Poser les deux béchers au milieu de la plaque de verre et recouvrir la plaque avec la cloche de verre.
- Il se forme très vite une intense fumée blanche dans la cloche, qui se dépose sous forme de poudre blanche sur la plaque de verre.
- Attendre 20 à 30 minutes, puis soulever la cloche (sous ventilation !), et enlever les deux béchers : jeter les deux solutions résiduelles. Observer la plaque de verre, blanchie partout sauf sous les béchers. Goûter (exceptionnellement) le dépôt blanc salé de chlorure d'ammonium NH4Cl
 .
. - Les gaz de chlorure d'hydrogène

 et d'ammoniac
et d'ammoniac 

 se sont évaporés de leurs solutions et réagissent selon l'équation :
se sont évaporés de leurs solutions et réagissent selon l'équation :
- NH3(g) +HCl(g) → NH4Cl(s)
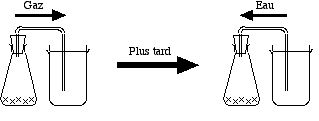
5 Transferts de proton de H2SO4 à NaCl, puis à H2O
- Préparer un erlenmeyer de 150 mL ou 200 mL équipé d'un bouchon de caoutchouc, percé d'un trou par où passe un tube de verre recourbé deux fois pour former un U. Le bouchon ne doit pas avoir de fuites !
- Recouvrir le fond de l'erlenmeyer de sel de cuisine sec, ou chlorure de sodium NaCl.
- Ajouter 50 mL d'acide sulfurique H2SO4 concentré
 et fermer très vite avec le bouchon muni du tube en verre doublement coudé. L'autre extrémité du tube doit plonger dans un erlenmeyer de même hauteur que l'erlenmeyer, plein d'eau.
et fermer très vite avec le bouchon muni du tube en verre doublement coudé. L'autre extrémité du tube doit plonger dans un erlenmeyer de même hauteur que l'erlenmeyer, plein d'eau. - On voit le gaz formé, le chlorure d'hydrogène HCl

 , chasser l'air qui barbotte à travers le bécher.
, chasser l'air qui barbotte à travers le bécher. - Puis les bulles ne traversent plus l'eau, car elles sont faites de HCl seul qui se dissout.
- Puis quand le dégagement de gaz se calme, on assiste avec surprise à un retour d'eau extrêmement tumultueux vers l'erlenmeyer.
Les réactions sont toutes des transferts de proton. Dans l'erlenmeyer, il se passe :
- H2SO4 + NaCl → NaHSO4 + HCl
ou mieux :
- H2SO4 + Cl– → HSO4– + HCl
Dans le bécher d'eau il se passe :
- HCl + H2O → H3O+ + Cl–
Remarque : Le retour d'eau ne se produit que si le bouchon est absolument étanche. L'expérience rate avec des vieux bouchons.
6 Coloration de flamme
Voir : Flammes colorées.
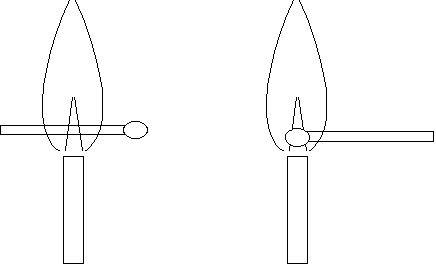
7 Flamme du bec Bunsen
On peut montrer que l'intérieur du cône bleu est froid en mettant rapidement une allumette tenue entre deux doigts en travers de la flamme, le plus bas possible : seules s'enflamment les parties qui sont à l'extérieur de la flamme. L'intérieur ne s'enflamme pas !
On peut aussi introduire la pointe de l'allumette au centre du cône bleu : il ne s'enflamme pas, alors que le bois s'enflamme. La pointe est faite de chlorate de potassium KClO3 ![]()
![]()
![]() , de colorant et de colle.
, de colorant et de colle.
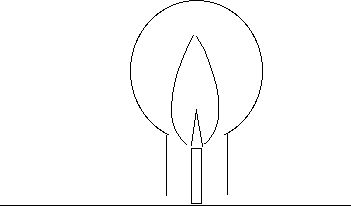
Si on veut montrer que la flamme dégage du dioxyde de carbone CO2 et H2O, coiffer la flamme avec un gros ballon.
Il se dépose de la buée et très vite la flamme s'éteint. Couper le gaz aussitôt, enlever le ballon, le boucher avec un bouchon de liège, et verser un peu d'eau de chaux à l'intérieur. Agiter : l'eau se trouble. Il s'est formé du dioxyde de carbone, qui réagit avec l'eau de chaux, une solution aqueuse d'hydroxyde de calcium Ca(OH)2 ![]()
![]() :
:
- Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
8 Combustion de l'essence

|
| GHS02 |
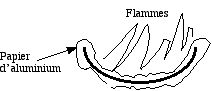
- Enrober une capsule en porcelaine dans une feuille d'aluminium de ménage.
- Verser quelques gouttes d'essence (benzine) qui est un mélange de divers hydrocarbures.
- Jeter sans attendre une allumette enflammée. L'essence brûle en dégageant une fumée noire, riche en carbone C, signe d'une combustion incomplète.
- La plupart des molécules d'octane C8H18 (et autres alcanes) brûlent selon l'équation globale :
- 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
- Mais quelques molécules d'octane C8H18 brûlent selon l'équation globale :
- 2 C8H18 + 9 O2 → 16 C + 18 H2O
- Indiquer que la réaction dure un certain temps, car chaque groupe de deux molécules d'essence doit se vaporiser et aller chercher 25 molécules d'oxygène pour réagir, et que cela prend du temps.
- Annoncer ensuite qu'on va réaliser la même expérience, mais dans un cas où chaque molécule d'essence dispose d'assez d'oxygène alentour pour que toutes les molécules puissent réagir en même temps : cela crée une explosion.
9 Principe du moteur à explosion

|
| GHS02 |
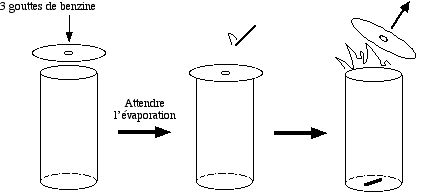
- Prendre un récipient cylindrique de verre d'environ 1 L de contenance (sans bec, donc pas un bécher). L'idéal est un bocal de café en poudre, vide.
- Déposer sur l'ouverture une rondelle de carton à peine un peu plus grand qu'elle, et munie d'un trou central, de 1 cm de diamètre.
- Prélever 1 mL d'essence, à l'aide d'une seringue de 1 mL. En injecter trois gouttes par le trou de la rondelle.
- Attendre une minute que la goutte se soit évaporée.
- Jeter alors une allumette enflammée par le trou de la rondelle sans en toucher le bord : aussitôt le mélange explose en soulevant le rondelle de quelques centimètres.
10 Combustion de métaux
10.1 Magnésium
Voir : Combustion du magnésium
10.2 Cérium
La pierre à briquet est faite de cérium (Ce) qui s'enflamme par frottement :
- 2 Ce(s) + 3 O2(g) → 2 Ce2O3(s)
10.3 Fer
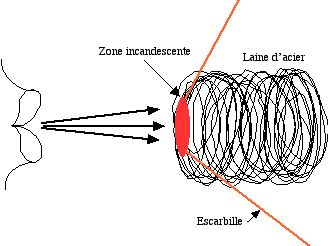
La laine d'acier, portée dans une flamme, s'enflamme à l'air. La combustion ne se maintient que dans un courant d'air. L'équation de la réaction est :
- 3 Fe(s) + 2 O2(g) → Fe3O4(s)
La poudre de fer s'enflamme : voir Les étincelles
Commentaires :
- Protéger la table au-dessus de laquelle on fait cet essai. Les escarbilles laissent des traces.
- L'augmentation de poids est quasi négligeable ! Inutile de songer faire des calculs stoechiométriques.
- Fe3O4 contient un atome de fer à l'état d'oxydation (+II) et deux atomes de fer à l'état d'oxydation (+III). On l'appelle parfois oxyde magnétique de fer ou magnétite, car Fe3O4 est attiré par l'aimant comme le fer. Sa formule développée peut être représentée par : O=Fe–O–Fe–O–Fe=O.
- Ne pas confondre cette oxydation avec la rouille, dont la formule est Fe2O3.
- Il peut être utile de savoir que la formation de rouille est un phénomène électrochimique qui demande quatre conditions :
- un grain de charbon à la surface du fer,
- une goutte d'eau,
- de l'air, pour le dioxygène,
- du dioxyde de carbone dans l’air.
Si l'une quelconque de ces quatre substances manque, le fer ne rouille pas.
- Il existe trois oxydes de fer : FeO, Fe2O3 et Fe3O4. Ce dernier est le plus stable à haute température.
11 Inflammation de la poudre noire
Il est rappelé que la fabrication de poudres pyrotechniques est interdite par la loi française, mais présente aussi des risques ! L'exemple est donné ici à titre informatif.
Connue depuis l'Antiquité, la poudre noire est un mélange de nitrate de potassium KNO3 ![]() (salpêtre), de carbone C et de soufre S
(salpêtre), de carbone C et de soufre S ![]() , qui réagit, lorsqu'on l'enflamme, selon l'équation de Liebig (1859) :
, qui réagit, lorsqu'on l'enflamme, selon l'équation de Liebig (1859) :
- 2 KNO3(s) + 3 C(s) + S(s) → K2S(s) + N2(g) + 3 CO2(g)
Proportions théoriques (en masse) : 74,8 % de KNO3, 13,3 % de carbone (charbon de bois), et 11,9 % de soufre. Ces proportions peuvent varier selon les livres ou encyclopédies consultées.
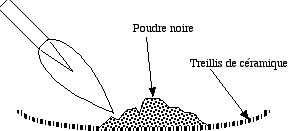
Pour préparer de la poudre noire, on mélange dans un mortier en porcelaine de quoi faire 40 g de poudre, on ajoute assez d'eau pour que le mélange soit pâteux, et on broie le tout soigneusement jusqu'à ce qu'on ne distingue plus de touches jaunes de soufre. C'est long... Puis on laisse sécher à l'air pendant 24 heures. En séchant, la poudre adhère au mortier. On la détache au couteau.
Ne jamais broyer le mélange sec ! Risque d'explosion prématurée ! ![]()
Pour enflammer la poudre noire, en verser un peu sur un treillis métallique imprégné de céramique ou sur une brique. Diriger la flamme du bec Bunsen directement. La poudre s'enflamme au bout de quelques secondes : ce n'est pas immédiat ! Joli effet pyrotechnique !

|
| GHS01 |
- Ne jamais mélanger le nitrate de potassium, le carbone et le soufre
 à sec. En 2001, un professeur en Irlande a perdu un œil en essayant de le faire. De toute manière l'adjonction d'eau dissout le salpêtre, qui pénètre mieux dans les grains de charbon.
à sec. En 2001, un professeur en Irlande a perdu un œil en essayant de le faire. De toute manière l'adjonction d'eau dissout le salpêtre, qui pénètre mieux dans les grains de charbon. - La poudre noire se conserve indéfiniment en flacon fermé. Elle supporte les chocs modérés. On ne connaît pas de cas d'auto-inflammation spontanée (contrairement à d'autres poudres ou la nitroglycérine



 ).
).
Commentaires :
- Utiliser un vieux treillis pour effectuer cet essai : l'inflammation endommage le treillis.
- Selon le Petit Larousse, la poudre noire contient : 75 % KNO3, 15 % C, et 10 % S. Il y a donc un excès de carbone.
- Seul ennui, à ne pas révéler aux élèves : l'analyse ne décèle pas de sulfure de potassium K2S dans les résidus, mais un mélange de carbonate de potassium K2CO3 et de thiosulfate de potassium K2S2O3.
12 Fusée au chlorate
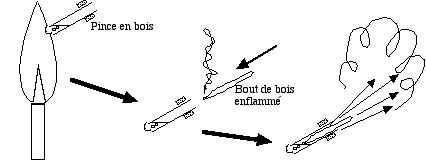
- Préparer un mini tube à combustion, un cure-dent et une pince à linge en bois.
- Remplir le fond du tube de poudre de chlorate de potassium KClO3


 sur 5 mm environ.
sur 5 mm environ. - Tenir le tube avec la pincette, placée près de l'ouverture. Chauffer au bec Bunsen. Le chlorate fond, puis se décompose en dégageant des bulles de dioxygène O2
 .
. - À ce moment sortir le tube de la flamme et y introduire rapidement un bout de bois (cure-dent par exemple) préalablement enflammé à une extrémité. Il brûle vivement dans le gaz issu de la décomposition. Mais si on le trempe dans la phase liquide, il se consume avec une telle vigueur qu'on croirait assister au départ d'une fusée.
Commentaires :
- La réaction créant le dioxygène est :
- 2 KClO3(s) → 2 KCl(s) + 3 O2(g)
- Il y a une réaction secondaire de dismutation en perchlorate de potassium KClO4 et chlorure de potassium KCl :
- 4 KClO3(s) → 3 KClO4(s) + KCl(s)
- Si on veut utiliser cette réaction pour préparer un grand volume de dioxygène, on a intérêt à ajouter un volume égal de oxyde de manganèse (IV)
 ou d'oxyde de fer (III) au chlorate de potassium
ou d'oxyde de fer (III) au chlorate de potassium 

 , avant de chauffer. La réaction est plus régulière. Elle ne génère pas de KClO4, et elle démarre à plus basse température.
, avant de chauffer. La réaction est plus régulière. Elle ne génère pas de KClO4, et elle démarre à plus basse température. - Cette méthode a servi au XIXe siècle à analyser les substances organiques, en mesurant la masse de CO2 et de H2O produit (méthode de Gay-Lussac).
13 Le nounours grognon
Une variante de la fusée au chlorate, consiste à remplacer le cure-dent par un bonbon gélifié (appelé nounours ou jujube). Il faut prévoir un tube de diamètre assez grand pour que le bonbon puisse tomber au fond. On observe alors une vive combustion entre la gélatine sucrée du bonbon (combustible) et le chlorate (comburant).
14 Manipulation de SO2 sans être gêné par l'odeur
Il faut tout d'abord préparer le dioxyde de soufre ![]()
![]() comme indiqué dans ici.
comme indiqué dans ici.
- Adapter une longue aiguille hypodermique (émoussée au préalable) à la pointe de l'une des seringues remplies de gaz.
- Prendre trois petites éprouvettes, pas plus longues que l'aiguille hypodermique.
- Remplir ces éprouvettes au quart en utilisant :
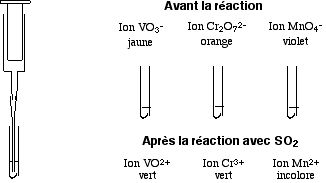
- dans la première une solution diluée de dichromate de potassium K2Cr2O7




 ,
, - dans la seconde une solution de vanadate d'ammonium NH4VO3
 acidifiée à l'acide sulfurique dilué,
acidifiée à l'acide sulfurique dilué, - dans la dernière une solution de permanganate de potassium KMnO4


 .
.
- dans la première une solution diluée de dichromate de potassium K2Cr2O7
Ces trois éprouvettes sont colorées respectivement en orange, jaune et violet.
- Introduire la pointe hypodermique de la seringue dans l'un de ces tubes. Appuyer pour faire barboter le gaz. Assez vite, on note que ce barbotage produit un changement de couleur.
Les équations des réactions sont les suivantes, tous les ions sont en solution aqueuse :
- 3 SO2(g) + Cr2O72–(orange) + 2 H+ → 2 Cr3+ + 3 SO42– + H2O
- SO2(g) + 2 VO3–(jaune) + 4 H+ → 2 VO2+ + SO42– + 2 H2O
- SO2(g) + 2 MnO4–(violet) + 2 H2O → 2 Mn2+ + 5 SO42– + 4 H+
Commentaires :
- On a intérêt à prendre des solutions les plus diluées possibles, car une seringue ne contient que peu de gaz. Selon la loi d'Avogadro, 0,001 mol de gaz occupe 25 mL. C'est peu, 0,001 mol. Une seringue de 10 mL ne contient donc guère plus de 0,2 à 0,3 mmol de SO2.
- Il vaut la peine de remarquer que :
- Les trois éléments V, Cr, et Mn se suivent dans le tableau périodique des éléments.
- Les degrés d'oxydation de V, Cr et Mn sont respectivement 5, 6 et 7 à l'état initial, ce qui est égal au numéro de la colonne dans la table.
- Leurs degrés d'oxydation à l'état final sont respectivement 4, 3 et 2, soit 9 moins le numéro de la colonne.
- DO(final) = 9 – DO(initial)
15 Circuits imprimés et équations redox
Il faut disposer de feuilles de plastique recouvertes de cuivre, telles que les électroniciens en emploient pour fabriquer leurs circuits imprimés. On peut s'en procurer en Suisse chez Conrad, sous le nom de plaques Isel® en dimension 10x16 cm, référence 526253-12.
- Découper une de ces feuilles avec une paire de ciseaux, de manière à avoir une bandelette assez étroite pour entrer sans frottements dans un gros tube à essais. En général, une bandelette de 50 mm de long sur 15 mm de large fait l'affaire.
- Écrire vos initiales sur la face cuivre avec un feutre indélébile noir. Repasser une ou deux fois, pour que la couche noire soit bien dense. Laisser sécher une minute.
- Préparer une solution de chlorure de cuivre (II) CuCl2

 à 1 mol/L, en dissolvant 17 g CuCl2•2H2O dans 100 mL d'eau.
à 1 mol/L, en dissolvant 17 g CuCl2•2H2O dans 100 mL d'eau. - Prendre le gros tube à essais où l'on va glisser ensuite la bandelette de cuivre. En prévoir un second identique, en réserve.
- Y introduire des volumes égaux de CuCl2

 à 1 mol/L, d'acide chlorhydrique concentré
à 1 mol/L, d'acide chlorhydrique concentré  , et d'eau oxygénée
, et d'eau oxygénée 
 H2O2(aq) à 30 %.
H2O2(aq) à 30 %. - La solution chauffe et verdit un peu, par suite de la formation de ions chlorocuprate CuCl42–.
- Y glisser la bandelette de cuivre, de manière à ce qu'elle soit immergée. Une vive réaction démarre avec dégagement de dioxygène gazeux. Le cuivre non protégé est attaqué rapidement.
- Transvaser plusieurs fois aller et retour la solution bleue-verte d'un tube dans un autre.
- Quand le cuivre non protégé par le vernis est détruit (au bout de 10 à 15 secondes) arrêter l'opération en vidant le liquide. Laver la bandelette à grande eau. Enlever le vernis noir à l'acétone. Il reste le motif dessiné mais imprimé dans le cuivre.
L'équation de la réaction chimique est :
- Cu(s) + 2 H+(aq) + H2O2(aq) → Cu2+(aq) + 2 H2O
Commentaires :
- La décomposition spontanée de H2O2 en H2O et O2 se produit simultanément, et donne lieu à une effervescence très visible.
- Cette opération est un peu délicate. Il faut laisser un minimum de temps la bandelette dans le bain cuivrique. Sinon le vernis est aussi attaqué, et il ne reste rien sur la bandelette plastique.
16 Illustration analogique de l'équilibre chimique
Il faut se procurer deux éprouvettes, ou tubes à essais, de diamètres différents, un gros et un mince. Il faut ensuite en percer le fond au chalumeau, et les fermer par un bouchon de caoutchouc percé lui-même d'un trou.
Prendre ensuite un bécher de 150 ou 200 mL de forme haute, rempli d'eau du robinet.
Avant de commencer la démonstration, bien expliquer que, en trempant un tel tube percé et bouché dans le bécher, on prélève toujours le même pourcentage de l'eau qui s'y trouve, quelqu'en soit le niveau. Si le tube mince en prélève 5%, le tube gros en prélèvera le double.
Prendre un deuxième bécher, identique au premier, mais vide, et le poser à côté de l'autre.
Énoncer clairement que le bécher de gauche désignera toujours les réactifs, et celui de droite les produits issus de la réaction, et ce toujours.
Expliquer aussi qu'on va transvaser simultanément 5% des produits de gauche et 10% des produits de droite, chaque fois vers l'autre bécher, et ceci avec les tubes percés.
Plonger simultanément les deux tubes dans les deux béchers. Attendre qu'ils se remplissent d'eau. Boucher avec le pouce. Sortir les deux tubes et les vider tous deux, et simultanément, dans l'autre bécher.
Répéter l'opération autant de fois qu'on le veut.
Assez vite on voit que le bécher de gauche (dont on prélève 5% du contenu par fois) se remplit au double de celui de droite (où on prélève 10% du contenu)
On peut continuer ce petit jeu aussi longtemps que l'on veut.L'état d'équilibre est atteint quand la quantité d'eau prélevée par chaque éprouvette est la même.
Ceci démontre que l'équilibre est un état dynamique.
17 Équilibre chimique
Voir : Solution de cobalt.
18 Fabrication de savon
Voir : Fabrication du savon.
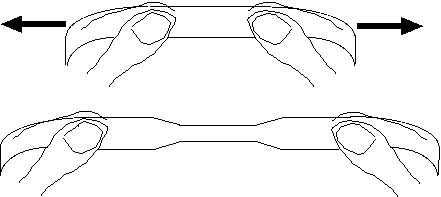
19 Étirement du polyéthylène
Se procurer des sachets à congélation, comme en utilisent les ménagères pour emballer la nourriture au congélateur. Ils sont en polyéthylène.
Découper avec une paire de ciseaux des bandes de plastique occupant toute la largeur du sachet, de manière à créer le moins d'irrégularités possible. Ces irrégularités sont des amorces de déchirures ultérieures. Largeur idéale de la bande : 1 cm. Observer que la bande plastique est presque transparente.
Saisir une de ces bandes entre le pouce et l'index de chaque main. Étirer très très très doucement ladite bande plastique. Elle s'étend peu à peu en s'amincissant et prenant un aspect parfaitement transparent.Quand la bande a acquis le double de longueur, on ne peut plus l'étendre. Elle acquiert une grande résistance à la traction. A cet instant les chaînes de polymères sont toutes parallèles.
Commentaires.
- L'éthène ou éthylène est formé de molécules de CH2=CH2. Sa polymérisation le transforme en longues chaînes linéaires dites de polyéthylène, ou PE : —CH2-CH2-[n]-CH2-CH2—. Le plastique brut contient de telles chaînes distribuées au hasard. Par étirement, elles se disposent parallèlement l'une à l'autre, et acquièrent une plus grande résistance à la traction.
- Quant à la polymérisation elle-même, elle peut se produire dans l'industrie de deux façons :
- soit à très haute pression (400 bars) en présence de traces de dioxygène comme catalyseur, auquel cas le polymère formé s'appelle polyéthylène basse densité (PELD),
- soit à pression ordinaire en présence du catalyseur de Ziegler-Natta, mélange de trichlorure de titane TiCl3 et de triéthylaluminium Al(C2H5)3, auquel cas on obtient du polyéthylène haute densité (PEHD).
20 Pouvoir rotatoire
Voir : Polarisation et pouvoir rotatoire
21 Auto-inflammation spontanée à froid
Voir : Auto-inflammation spontanée à froid