Auto-inflammation spontanée à froid
Un article du site scienceamusante.net.
Cette expérience illustre la très grande réactivité de certains produits, qui peuvent provoquer une inflammation spontanée s'ils sont mélangés, même à l'état de poudre. Les prestidigitateurs utilisent parfois de telles réactions pour des effets spectaculaires. Cependant les produits utilisés ici présentent un grand danger.
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Le chlorite de sodium est toxique


 et très réactif. Se protéger correctement.
et très réactif. Se protéger correctement.
2 Matériel et produits
- Capsule de porcelaine.
- Thiocyanate d'ammonium NH4SCN
 en poudre. On peut aussi utiliser du thiocyanate de potassium KSCN
en poudre. On peut aussi utiliser du thiocyanate de potassium KSCN  .
. - Chlorite de sodium NaClO2


 en poudre.
en poudre.
- Il est assez difficile de se procurer ce produit. On en trouve chez Acros au prix d'environ 40 € les 500 g.
- Il s'oxyde facilement au contact de l'air et se transforme en chlorate, non réactif.
- Ne pas confondre le terme chlorite avec les deux termes voisins chloride (équivalent anglais de chlorure), et chlorate.
3 Protocole
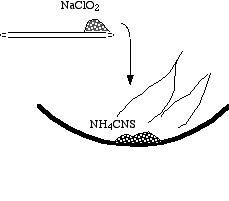
- Mettre deux ou trois pointes de spatule de thiocyanate d'ammonium NH4SCN
 dans une capsule de porcelaine.
dans une capsule de porcelaine. - Jeter par-dessus une petite pointe de chlorite de sodium NaClO2


 . Un jet de flamme spontané apparaît au contact des deux poudres. Si ce n'est pas le cas, ajouter une goutte d'eau (pas plus d'une !). On peut continuer à verser davantage de chlorite : à chaque adjonction, une nouvelle flamme se produira.
. Un jet de flamme spontané apparaît au contact des deux poudres. Si ce n'est pas le cas, ajouter une goutte d'eau (pas plus d'une !). On peut continuer à verser davantage de chlorite : à chaque adjonction, une nouvelle flamme se produira.
4 Explication
- L'équation de la réaction est :
- NH4SCN(s) + NaClO2(s) → NaCl(s) + N2(g) + 2 H2O(g) + S(s)
- Le mélange s'échauffe, et jaunit par suite de la formation de soufre. Mais ce soufre finit par réagir avec le chlorite de sodium si ce dernier est en excès, selon l'équation :
- NaClO2(s) + S(s) → NaCl(s) + SO2(g)
- En conséquence, il se dégage du dioxyde de soufre SO2

 gazeux d'odeur piquante !
gazeux d'odeur piquante !
5 Voir aussi
- Une autre réaction spontanée avec flamme : Du feu sans allumette ni briquet
Merci à Maurice Cosandey pour cette contribution.