Les jardins chimiques
Un article du site scienceamusante.net.
Autrement appelé "liqueur de cailloux", le silicate de sodium permet de réaliser une belle expérience utilisant des sels métalliques en vue d'obtenir des structures semblables à des coraux ou à des algues sous-marines. Dans les années 1900, le médecin Stéphane Leduc avait étudié toutes les possibilités de combinaison entre des sels métalliques et des solutions à base de carbonate, de phosphate ou de silicate de sodium. Il pensait avoir "recréé la vie" en observant ces croissances surprenantes à base de composés chimiques complètement inertes...[1][2][3]
Sommaire
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Porter des gants et des lunettes de protection. Éviter tout contact avec la solution de silicate de sodium
 , car celle-ci contient une grande quantité d'hydroxyde de sodium
, car celle-ci contient une grande quantité d'hydroxyde de sodium  très corrosive.
très corrosive. - Il est hors de question de tenter l'expérience dans un aquarium contenant des poissons vivants !... Certains sels métalliques sont toxiques !

2 Matériel
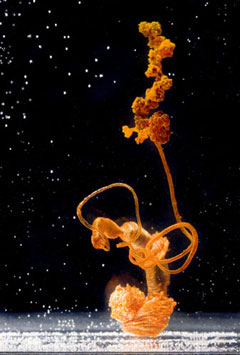
Dans une solution de silicate de sodium diluée, croissance de chlorure de fer III. © 2006 Photo S. Querbes, réalisation Anima-Science et Les atomes crochus pour La Recherche n°400 (septembre 2006).

Chlorure de cobalt. © 2006 Photo S. Querbes, réalisation Anima-Science et Les atomes crochus pour La Recherche n°400 (septembre 2006).

Sulfate de cuivre. Les points blancs sont des minuscules bulles d'air accrochées sur la vitre de l'aquarium. © 2006 Photo S. Querbes, réalisation Anima-Science et Les atomes crochus pour La Recherche n°400 (septembre 2006).
- Un bécher de 1 ou 2 L
- Silicate de sodium concentré, 1 L

- Eau distillée
- Sels métalliques en poudre ou en granulé :
- Sulfate de cuivre pentahydraté CuSO4,5H2O



- Sulfate de nickel heptahydraté NiSO4,7H2O



- Sulfate de fer (II) heptahydraté FeSO4,7H2O

- Chlorure de fer (III) FeCl3

- Chlorure de cobalt hexahydraté CoCl2,6H2O



- Chlorure de calcium CaCl2

- Sulfate de manganèse monohydraté MnSO4,H2O

 (ou tétrahydraté)
(ou tétrahydraté)
- Sulfate de cuivre pentahydraté CuSO4,5H2O
3 Protocole expérimental
- Préparer la solution dans le grand bécher en mélangeant moitié silicate de sodium et moitié eau distillée. Bien mélanger pour homogénéiser. Attention cette solution ne se conserve pas longtemps à l'air libre car le gaz carbonique forme un carbonate qui trouble la solution.
- À l'aide d'une spatule, saupoudrer la surface de sulfate de nickel heptahydraté


 (vert) qui doit couler au fond du bécher. Puis ajouter les grains des autres sels métalliques qui doivent aussi couler au fond du bécher.
(vert) qui doit couler au fond du bécher. Puis ajouter les grains des autres sels métalliques qui doivent aussi couler au fond du bécher. - Après quelques secondes, on remarque que le sulfate de nickel semble pousser comme du gazon.
- Les autres sels métalliques forment des tiges vers le haut, de différente forme et couleur selon le sel.
- Au bout de 30 minutes environ, la forêt a terminé sa croissance. Avec la spatule, constater que les tiges sont rigides et que le fond est très dur et bien accroché aux parois du bécher.
- Cette solution peut se conserver telle quelle à condition de couvrir le bécher à l'aide d'un film plastique. Quelques bouts de tiges peuvent se détacher au fil du temps.
- Pour nettoyer, diluer à grande eau le silicate de sodium, gratter les cailloux avec une spatule métallique et les jeter à la poubelle (pour ne pas boucher l'évier).
4 Explications
- Lorsque les sels métalliques sont dans la solution, ceux-ci ont tendance à se solvater, c'est à dire que les sels se dissolvent en ions en s'entourant de molécules d'eau. Par exemple avec le chlorure de fer (III) :
- FeCl3(s) + n H2O → Fe3+(aq) + 3 Cl–(aq)
- Les ions métalliques forment un précipité insoluble au contact du silicate, ce qui forme une pellicule (ou enveloppe) solide, éventuellement cristalline, mais relativement poreuse et perméable à l'eau de la solution de silicate. À l'intérieur de cette enveloppe, on trouve le sel métallique introduit ; à l'extérieur, la solution de silicate. L'eau de la solution peut entrer par osmose à l'intérieur, faisant augmenter son volume. Ainsi l'enveloppe gonfle et se déchire par endroit, laissant échapper la solution intérieure, concentrée en sel métallique, qui reforme la pellicule poreuse au contact du silicate. Et ainsi de suite...
- L'explication de ce phénomène repose essentiellement sur deux notions de physique :
- L'osmose ou pression osmotique : En présence du silicate de sodium, les ions métalliques forment des silicates métalliques. Une enveloppe solide mais semi-perméable se forme autours du granulé. À cause de la différence de concentration entre l'intérieur et l'extérieur de la membrane et parce que cette parois est poreuse, l'eau entre par osmose. La pression à l'intérieur de l'enveloppe augmente jusqu'à sa rupture.
- La poussée d'Archimède : Elle est due à la différence de densité entre le silicate de sodium et l'intérieur de l'enveloppe poreuse. Par osmose, l'eau qui entre dans les enveloppe dissout le sel métallique s'y trouvant et la densité diminue. Lorsque celle-ci devient inférieure à la densité de la solution de silicate, une force dirigée de bas en haut (la fameuse poussée d'Archimède). Lors de la rupture de l'enveloppe, le liquide intérieur monte à travers la solution de silicate en formant des branches.
- Au fur et à mesure que ces branches montent, la parois poreuse se reforme et le processus se poursuit grâce aux actions combinées de l'osmose et de la différence de densité.
- On remarque que les branches peuvent s'allonger d'autant plus rapidement et longuement que le sel utilisé est hygroscopique, c'est à dire avide d'eau. Ceci peut expliquer pourquoi le chlorure de fer (III) et le chlorure de cobalt hexahydraté, très hygroscopiques, donnent de grandes branches boursouflées, alors que les autres sels, moins hygroscopiques, ne forment que des branches fines ou plus courtes.
- On observe aussi l'apparition de bulles d'air provenant soit de l'air dissout dans l'eau distillée, soit des bulles contenues dans les poudres. Ces bulles ont tendance à remonter en surface, entraînant avec elles le sel métallique dissout dans l'eau, aidant ainsi à la formation des tentacules ou des branches. Parfois ces bulles se détachent.
- La couleur dépend de l'ion métallique :
| Cation | Couleur |
|---|---|
| Cu2+ | Bleu |
| Ni2+ | Vert clair |
| Fe2+ | Vert foncé |
| Fe3+ | Orange à rouille |
| Co2+ | Rose, vert, bleu à mauve |
| Ca2+ | Blanc |
| Mn2+ | Blanc, rose pâle à beige |
- On remarque que la forme des branches dépend de la taille des granulés :
- forme d'herbe pour le sulfate de nickel heptahydraté s'il est très fin
- branches fines pour le sulfate de cuivre pentahydraté, le chlorure de calcium et le chlorure de cobalt hexahydraté s'ils sont en poudre
- branches irrégulières pour le sulfate de fer (II) heptahydraté
- branches épaisses pour le chlorure de fer (III) s'il se présente sous la forme de grains de grosse taille
5 Recyclage et élimination du silicate de sodium
La question du recyclage ou de l'élimination du silicate de sodium ![]() se pose souvent.
se pose souvent.
- Recyclage : par soucis d'économie, on peut recycler le silicate de sodium en le filtrant à l'aide d'un montage de fiole à vide et verre fritté, pour éliminer les particules solides en suspension. Cette filtration rapide (car la solution est visqueuse) évite aussi sa carbonatation à cause du dioxyde de carbone contenu dans l'air. Rincer immédiatement le fritté ensuite avec de l'eau distillée sinon il risque de se boucher de manière irréversible ! Il est déconseillé d'utiliser un système de filtration sur papier ou sur tissu car le silicate de sodium a tendance à colmater les fibres de cellulose ; de plus la solution est trop visqueuse pour cela.
- Élimination : étant fortement basique, il est conseillé de le neutraliser avec de l'acide chlorhydrique
 . Il se forme alors de fines particules de silice blanche et de chlorure de sodium en suspension dans l'eau (gel de silice). Ce gel de silice peut être lavé à l'eau distillée et filtré, puis utilisé pour une autre application (chromatographie sur colonne par exemple). La solution neutralisée peut ainsi être éliminée au tout-à-l'égout sans risque de pollution. Attention : la neutralisation du silicate de sodium basique par un acide fort dégage beaucoup de chaleur et risque de faire des projections corrosives ! Se protéger efficacement ! L'élimination directe du silicate dans un évier risquerait de boucher de manière irréversible les canalisations !
. Il se forme alors de fines particules de silice blanche et de chlorure de sodium en suspension dans l'eau (gel de silice). Ce gel de silice peut être lavé à l'eau distillée et filtré, puis utilisé pour une autre application (chromatographie sur colonne par exemple). La solution neutralisée peut ainsi être éliminée au tout-à-l'égout sans risque de pollution. Attention : la neutralisation du silicate de sodium basique par un acide fort dégage beaucoup de chaleur et risque de faire des projections corrosives ! Se protéger efficacement ! L'élimination directe du silicate dans un évier risquerait de boucher de manière irréversible les canalisations !
6 Vidéos
- Sur le site de Stéphane Querbes : http://www.stephanequerbes.com/portfolio/video-chemical-gardens/
7 Références
- ↑ Stéphane Leduc, La biologie synthétique, étude de biophysique, A. Poinat, Paris, 1912 ; http://www.peiresc.org/bstitre.htm
- ↑ Stéphane Leduc, The Mechanism of Life, William Heinemann, London, 1911 ; http://www.archive.org/details/mechanismoflife029804mbp
- ↑ Stéphane Leduc, La croissance osmotique, Association française pour l'avancement des sciences, Lille, 1909, Notes et mémoires, p. 205. ; http://gallica2.bnf.fr/ark:/12148/bpt6k201207x.image.f209
- Les jardins chimiques, Richard-Emmanuel Eastes, Clovis Darrigan, La Recherche n°400 (septembre 2006), page 90.
- Les jardins chimiques : un faux pas vers la vie synthétique, Richard-Emmanuel Eastes, Clovis Darrigan, Xavier Bataille, Pour la Science n°375 (janvier 2009).
- Expliquer la vie... Effets d'osmose, Richard-Emmanuel Eastes, Clovis Darrigan, Xavier Bataille.
- Recréer la vie ? Jardins chimiques et cellules osmotiques, Richard-Emmanuel Eastes, Clovis Darrigan, Stéphane Querbes, conférence à l'ESPCI (2007)
- Article dans l'Actualité Chimique, revue de la SCF : http://www.lactualitechimique.org/spip.php?numero_article1547
- Formation of Chemical Gardens, Julyan H. E. Cartwright, Juan Manuel García-Ruiz, María Luisa Novella, and Fermín Otálora, Journal of Colloid and Interface Science 256, pp. 351–359 (2002) - doi:10.1006/jcis.2002.8620
- Chemical synthesis of biomimetic forms, Jacques Livage, C.R. Palevol 8, pp. 629–636 (2009) - doi:10.1016/j.crpv.2008.11.009
- Characterization of cobalt precipitation tube synthesized through "silica garden" route, Kavita Parmar et al., Materials Characterization 60, pp. 863-868 (2009) - doi:10.1016/j.matchar.2009.02.003