Synthèse des esters de cholestéryle
Les esters de cholestéryle font partis des tout premiers cristaux liquides synthétisés. Leur synthèse se fait généralement par acylation de l’alcool secondaire au moyen d’anhydride ou de chlorure d’acide en présence d’une base.
De nombreux auteurs ont rapporté pour un même composé des températures de changement d’état qui diffèrent suivant le mode de préparation. Notons de plus que ces températures dépendent de la pureté des produits. De nombreux auteurs préconisent de recristalliser le produit autant de fois que nécessaire jusqu’à obtention d'une température de changement d’état fixe. Ces recristallisations pouvant généralement varier de trois à cinq, nous nous contenterons d’une seule recristallisation, suffisante pour pouvoir observer les changements d’états.
Les mesures des différentes températures de transition entre états peuvent être réalisés facilement en plaçant un peu de produit dans un tube capillaire et en chauffant ce dernier au moyen d’un dispositif permettant une lecture et un réglage précis de la température (appareil dédié, tube de Thiel...). Le banc Koefler pourra être utilisé, mais de façon bien moins pratique.
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Les différents chlorures d’acides
 sont à manipuler avec précautions en raison de leur caractère corrosif et lacrymogène, ils s’hydrolysent facilement pour donner de l’acide chlorhydrique
sont à manipuler avec précautions en raison de leur caractère corrosif et lacrymogène, ils s’hydrolysent facilement pour donner de l’acide chlorhydrique  .
. - La pyridine

 est un liquide incolore d’odeur très désagréable, facilement inflammable et irritant. En cas d’exposition prolongée, c’est un toxique du foie et des reins.
est un liquide incolore d’odeur très désagréable, facilement inflammable et irritant. En cas d’exposition prolongée, c’est un toxique du foie et des reins. - Le chlorure de thionyle

 est un liquide incolore, d’odeur désagréable, corrosif pour la peau et les muqueuses.
est un liquide incolore, d’odeur désagréable, corrosif pour la peau et les muqueuses. - Le diméthylformamide

 est liquide incolore, nocif par inhalation et contact avec la peau. À manipuler avec précautions.
est liquide incolore, nocif par inhalation et contact avec la peau. À manipuler avec précautions. - La 4-méthoxyaniline
 est un solide foncé, très toxique. À manipuler avec précautions.
est un solide foncé, très toxique. À manipuler avec précautions.
2 Matériel et produits
- Ballon monocol de 50 mL
- Réfrigérant à boules
- Barreau aimanté et agitateur magnétique chauffant
- Bain d’huile
- Bain eau/glace
- Filtre en verre fritté N°3
- Système de filtration sous vide
- Chlorures d'acyles, au choix :
- Cholestérol
- Pyridine


- Méthanol



- Acétate d'éthyle


3 Mode opératoire
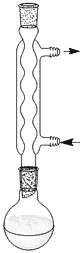
- Réaliser un montage à reflux comme illustré ci-contre.
- Introduire dans le ballon :
- 4 g de cholestérol,
- 12 mL de pyridine

 et agiter jusqu’à dissolution.
et agiter jusqu’à dissolution.
- Ajouter 1,6 mL de chlorure de benzoyle
 puis chauffer au reflux pendant 10 minutes.
puis chauffer au reflux pendant 10 minutes. - Laisser revenir à température ambiante puis refroidir dans un bain eau/glace.
- Ajouter 60 mL de méthanol


 puis filtrer sur un filtre en verre fritté.
puis filtrer sur un filtre en verre fritté. - Essorer les cristaux sur le filtre puis les rincer par 20 mL de méthanol.
- Recristalliser le solide dans environ 80 à 100 mL d’acétate d'éthyle

 .
.
Selon la même procédure, il est possible de préparer avec de bons rendements :
- l'acétate de cholestéryle, avec 1 mL de chlorure d’acétyle
 ,
, - l'hexanoate de cholestéryle, avec 2 mL de chlorure d’hexanoyle
 ,
, - le laurate de cholestéryle, avec 3,2 mL de chlorure de lauroyle
 .
.
Notons que, pour ces composés, l’étape de recristallisation nécessite bien moins d’acétate d'éthyle (de 10 à 20 mL en moyenne).
4 Résultats et discussion
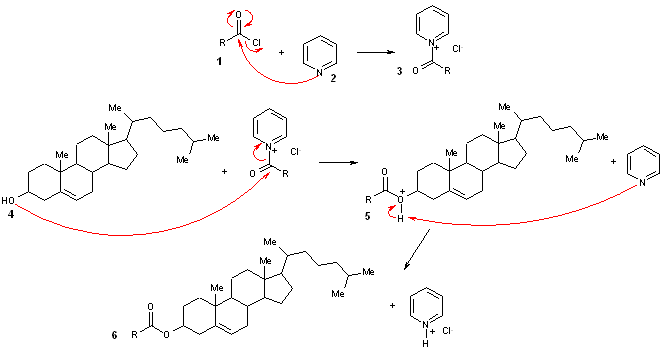
- On utilise ici un léger excès de chlorure d'acide (1,3 eq) pour compenser la dégradation partielle du produit. En effet, dans la bouteille, une partie du chlorure d'acyle s’hydrolyse en acide chlorhydrique et acide carboxylique. L’excès permet de compenser cette dégradation. On peut cependant utiliser des quantités stoechiométriques, mais seulement lorsque l'on est sûr de la pureté du chlorure d'acyle utilisé (distillation fraîche ou récente).
- La réaction se déroule suivant le mécanisme suivant. Dans un premier temps, l’azote de la pyridine 2 réagit en tant que nucléophile sur le chlorure d’acide 1 pour former le sel de pyridinium correspondant 3. En raison de la charge positive portée par l’azote, le groupe carbonyle est plus électrophile que celui du chlorure d’acide et réagira plus rapidement avec l’alcool du cholestérol 4. Lors de cette réaction, la pyridine est libérée. Elle va alors réagir en tant que base pour piéger le chlorure d'hydrogène libéré.
- Lors de l’ajout des chlorures d’acides au milieu réactionnel, on observe la formation d’une fumée blanche. Celle-ci est constituée de microcristaux de chlorure de pyridinium formé par réaction entre HCl

 (qui se dégage) et la pyridine présente en phase gazeuse.
(qui se dégage) et la pyridine présente en phase gazeuse.
Rapidement, un produit précipite, qui se redissout par chauffage. En fin de réaction, le retour à température ambiante entraîne la précipitation de l’ester qui est récupéré par filtration.
- Par recristallisation, les esters sont obtenus sous forme cristalline (ou amorphe pour l’acétate) avec de bons rendements.
5 Cristaux liquides, lumière polarisée et chauffage : le trio gagnant !
Avec tous ces cristaux en main, il serait dommage de ne pas prendre quelques photos sous lumière polarisée tout en chauffant un peu pour observer les différents états.
Les températures de transitions rapportées ici peuvent varier de quelques degrés en fonction de la pureté des composés ainsi que du calibrage des appareils de mesure.
| Cristal liquide | Température de passage à l’état cristal liquide (°C) | Température de passage à l’état liquide isotrope (°C) |
|---|---|---|
| MBBA | 20,0 | 38,1 |
| TBBA | 147,5 | 199,5 |
| Imine dérivée du MBBA | 129,8 | 183,7 |
| Benzoate de cholestéryle | 151,0 | 179,1 |
| Hexanoate de cholestéryle | 96,8 | 98,5 |
| Lauroate de cholestéryle | 90,1 | 91,5 |
| Acétate de cholestéryle | 95,7 | 117,2 |
Quelques photographies de cristaux de benzoate de cholestéryle obtenues en faisant tourner l’un des filtres polarisants :
Quelques photographies prises lors du chauffage régulier d’un échantillon de benzoate de cholestéryle sous lumière polarisée :

Vidéo de fusion du benzoate de cholestéryle. (AVI, 2,3 Mo) © William Erb, 2009.
En raison de l’étroitesse de la plage de température séparant l’état solide de l’état liquide isotrope, une seule photo de l’hexanoate de cholestéryle a pu être prise :
Vidéo de fusion de l’hexanoate de cholestéryle. (AVI, 952 ko) © William Erb, 2009.
6 Voir aussi
- Généralités sur les cristaux liquides
- La synthèse du MBBA
- La synthèse du TBBA
7 Références