Les porphyrines
Ces molécules et leurs dérivés nous entourent. Elles sont indispensables à notre vie et leur nom reste pourtant inconnu de beaucoup... Voilà de quoi y remédier !
Sommaire
[masquer]1 Structure
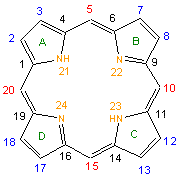
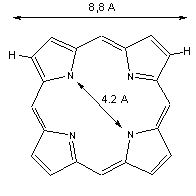
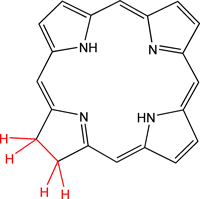
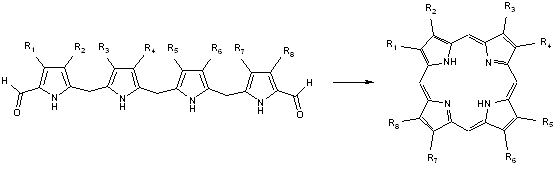
Les porphyrines sont des molécules macrocycliques (cycle de grande taille) tétrapyrroliques (formées de quatre molécules de pyrrole) mesurant environ 9 Å de long pour un diamètre de 4,2 Å[1], une propriété importante comme nous allons le voir.
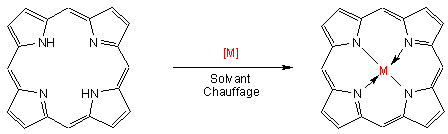
En effet, il est possible d’insérer au centre de la cavité formée un ion métallique : on parlera alors de métallo-porphyrines. Le complexe formé possède des propriétés tout à fait particulières mises à profit dans diverses activités biologiques. Notons que cette insertion peut se faire directement par les organismes vivants (biosynthèse) ou par les chimistes (synthèse en faisant réagir la porphyrine avec un sel métallique[2]) :
2 Exemples de porphyrines
Les noyaux porphyrine, les métallo-porphyrines et leurs dérivés sont des structures de base de la chimie du vivant, essentielles à la vie, que l’on retrouve dans différentes molécules telles :
- L’hème, constituant l’hémoglobine du sang des animaux, qui permet de transporter le dioxygène des poumons vers tout les organes et tissus du corps. C'est ici un ion Fe2+ qui se trouve complexé au centre du noyau.
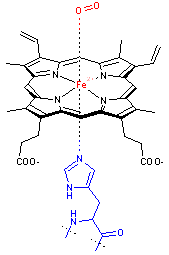 Le groupement hème de l’hémoglobine. Le complexe Fe(II)-hème est montré sous forme liée à l’histidine (en bleu) et au dioxygène. |
- Les cytochromes P450, qui sont des enzymes chargées d’éliminer les substances étrangères à l’organisme :
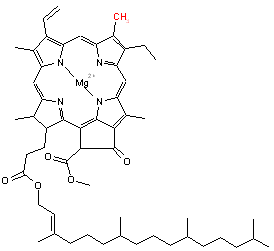
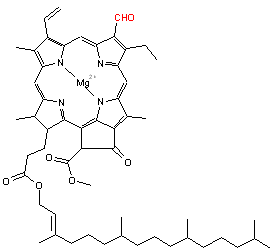
- La chlorophylle, qui est une forme dérivée de porphyrine, la chlorine, qui assure la photosynthèse chez les plantes (Fig. 5). L’ion magnésium Mg2+ est ici présent et la double liaison en bas à gauche du noyau n'est pas hydrogénée.
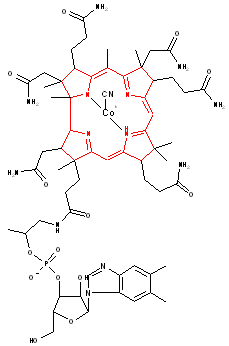
- La cyanocobalamine, qui plus connue sous le nom de vitamine B12, est essentielle au bon développement du corps. C’est cette fois un ion cobalt Co2+ qui est complexé au centre. Le noyau porphyrine a aussi une légère modification : un méthylène du noyau a été supprimé, ce noyau s'appelle une corrine, qui n'est plus aromatique. Cette molécule a été synthétisée pour la première fois par Robert Woodward.
- Des porphyrines contenant du cuivre [4], qu'auraient certains crustacés à sang vert.
Il existe d'autres molécules basées sur la porphyrine contenant des métaux tels que : manganèse, nickel, zinc. L’ensemble de ces activités font des porphyrines des molécules très étudiées depuis plus d’un siècle.
3 Quelques utilisations des porphyrines
Depuis plusieurs dizaines d’années, les porphyrines ont su trouver de nombreuses applications. Nous ne citerons ici que les principales :
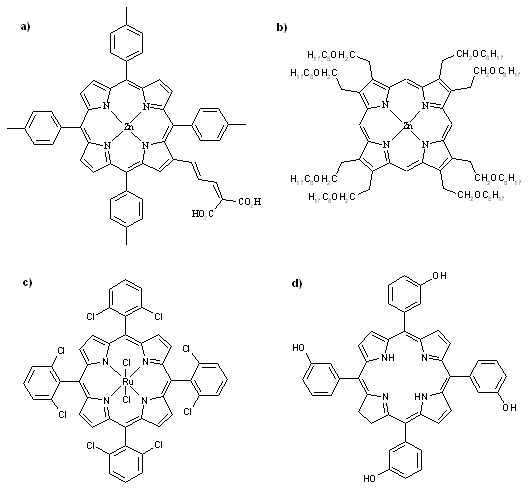
- La fabrication de cellules solaires pour la conversion directe de la lumière en électricité avec un rendement maximal de conversion de 7,1 %[5] (a)
- La préparation de cristaux liquides utilisables dans l’ensemble des dispositifs d’affichages (des montres aux écrans d’ordinateurs)[6] (b)
- L’utilisation comme catalyseurs en chimie organométallique (réactions d’époxydation, d’oxydation, de cyclopropanation, formation de pyrrolines, de furanes…)[7][8][9] (c)
- Utilisation en chimie thérapeutique avec la thérapie photodynamique associant un colorant tétrapyrrolique (telle les porphyrines), de la lumière et l’oxygène dissout dans le sang pour détruire des cellules cancéreuses[10] (d)
Et la liste est encore longue !
4 Méthodes de synthèses
Pour pouvoir former des porphyrines permettant autant d’utilisations, les chimistes ont développé de nombreuses méthodes de synthèses (avec leurs avantages et inconvénients) :
- La méthode d’Adler et Longo qui est utilisée dans la synthèse de la tétraphénylporphyrine est l’une des plus simple à mettre en œuvre mais souffre de rendements médiocres et du fait que les conditions réactionnelles (acide ou reflux) ne permettent pas la formation de porphyrines portant des groupes trop sensibles.
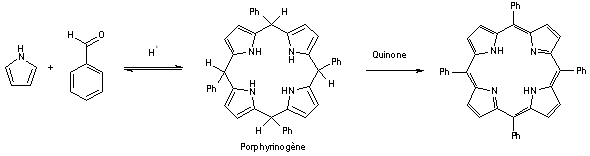
- La méthode de Lindsey permet de former des porphyrines substituées en position méso (comme la tétraphénylporphyrine) par réaction entre un aldéhyde et le pyrrole dans un milieu acide très dilué pour former le porphyrinogène qui est ensuite oxydé en porphyrine. Cette méthode, permettant l’accès à des porphyrines portant des substituants fragiles avec de bons rendements souffre de la dilution qui ne permet pas de préparer de grandes quantités de composé[11][12].
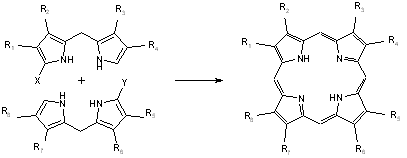
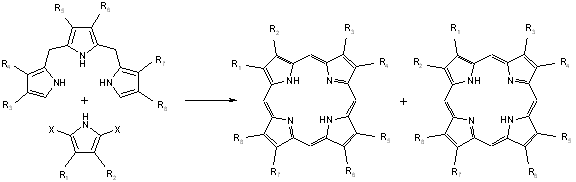
- Les diverses méthodes "2+2", "3+1", "4+0", suivant le nombre de groupes pyrroles se trouvant dans chaque molécule que l’on fait réagir, permettent l’accès à des motifs divers mais sont plus longues que les méthodes pré-citées[13][14][15][16][17][18][19][20] :
- La fonctionnalisation de porphyrines formées par les méthodes précédentes par diverses réactions (bromation puis couplage organométallique, réaction avec des lithiens, métathèse, etc.)
5 Des porphyrines aux porphyrinoïdes
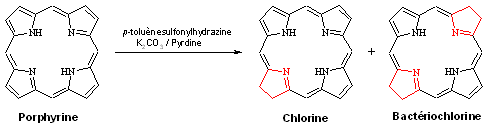
Si les porphyrines sont des motifs importants (à la vue des nombreuses utilisations), il a été montré que d’un point de vue thérapeutique, les chlorines et bactériochlorines étaient plus actives dans les traitements de cancers que les porphyrines. Or il est justement possible de préparer ces molécules par une réaction de réduction des porphyrines développée par Withlock[21].
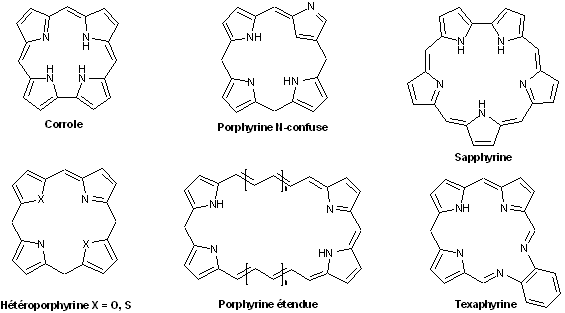
Enfin, il serait criminel de passer à coté des porphyrinoïdes, ces molécules apparentées aux porphyrines mais sans en être avec les chlorines et bactériochlorines, les porphyrines « N-confusent », les hétéroporphyrines et l’ensemble des macrocycliques apparentés de plus grande taille (certains incluant jusqu’à 16 unités pyrroliques, les hexadécaphyrines).[22]
6 Références
- Aller ↑ Bonnett R. ; Chemical Aspects of Photodynamic Therapy, Gordon and Breach Science Publishers, 2000
- Aller ↑ Rothemund P., Menotti A.R. ; J. Am. Chem. Soc., 1948, 70, 1808
- Aller ↑ Hasemann C. A., Ravichandran K. G., Peterson J. A., Deisenhofer J. ; J. Mol. Biol., 1994, 236, 1169
- Aller ↑ Wikipédia - Porphyrine : http://fr.wikipedia.org/w/index.php?title=Porphyrine&oldid=15398176
- Aller ↑ Campbell W. M., Jolley K. W., Wagner P., Wagner C., Walsh P. J., Gordon K. C., Schmidt-Mende L., Nazeeruddin M. K., Wang Q., Grätzel M., Officer D.L. ; J. Phys. Chem. C, 2007, 111, 11760
- Aller ↑ Gregg B. A., Fox M. A., Bard A. L. ; J. Am. Chem. Soc., 1989, 111, 3024
- Aller ↑ Che C. M., Chen J. ; Angew. Chem. Int. Ed., 2004, 43, 4950
- Aller ↑ Rosenthal J., Luckett T. D., Hodgkiss J. M., Nocera D. G. ; J. Am. Chem. Soc., 2006, 128, 6546
- Aller ↑ Xu H. W., Li G. Y., Wong M. K., Che C. M. ; Org. Lett., 2005, 7, 5349
- Aller ↑ http://www.exchem.fr/TherapiePDT.pdf
- Aller ↑ Lindsey J. S., Schreiman I. C., Hsu H. C., Kearney P. C., Marguerettaz A. M. ; J. Org. Chem., 1987, 52, 827
- Aller ↑ Lidsey J. S., Hsu H. C., Schreiman I. C. ; Tet. Let., 1986, 27, 4969
- Aller ↑ Arsenault G. P., Bullock E., MacDonald S. F. ; J. Am. Chem. Soc., 1960, 82, 4384
- Aller ↑ Boudif A., Momenteau M. ; J. Chem. Soc., Chem. Comm., 1994, 2069
- Aller ↑ Boudif A., Momenteau M. ; J. Chem. Soc., Perkin Trans. 1, 1996, 1235
- Aller ↑ Lash T.D. ; Chem Eur. J., 1996, 2, 1197
- Aller ↑ Corwin A. H., Coolidge E. C. ; J. Am. Chem. Soc., 1952, 74, 5196
- Aller ↑ Jackson A. H., Kenner G. W., McGillivray G., Sach G. S. ; J. Am. Chem. Soc., 1965, 87, 676
- Aller ↑ Rezzano I., Buldain G., Frydman B. ; J. Org. Chem., 1986, 51, 3968
- Aller ↑ Jeyakumar D., Snow K. M., Smith K. M. ; J. Am. Chem. Soc., 1988, 111, 8562
- Aller ↑ Whitlock H. W., Hanauer R., Oester M. Y., Bower B. K. ; J. Am. Chem. Soc., 1969, 91, 7485
- Aller ↑ Sessler J. L., Seidel D. ; Angew. Chem. Int. Ed., 2003, 42, 5134