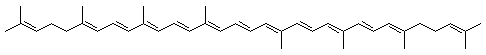
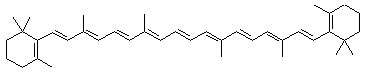
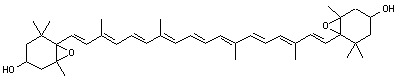
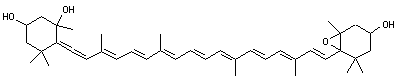
La chlorophylle
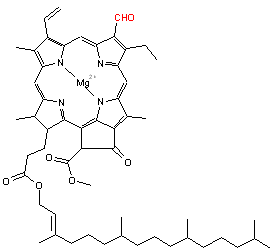
La chlorophylle est un pigment présent dans toutes les plantes vertes sur Terre. On estime que près d’un milliard de tonnes de chlorophylle sont synthétisées par les plantes chaque année sur toute la surface de la Terre [1].
C’est grâce à cette molécule que la plante est capable de réaliser la photosynthèse, c'est à dire la préparation de glucose (le carburant de la plante) à partir de molécules organiques simples (eau et dioxyde de carbone) sous l’action de la lumière visible.
La chlorophylle est contenue dans les chloroplastes, de minuscules organites situés à l'intérieur de chacune des cellules d'une plante verte, essentiellement dans les feuilles.
La chlorophylle a été tout d’abord isolée par les chimistes Français Pelletier et Caventou qui lui ont donné son nom en référence à la couleur verte (chloro) des feuilles (phylle). Elle a longtemps passionné les chercheurs, comme le prouve les travaux de célèbres chimistes : Berzelius, Frémy, Willstätter pour ne citer qu’eux…
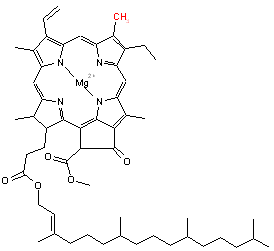
Ce que l’on nomme couramment chlorophylle est en réalité un mélange de plusieurs molécules de structures chimiques très proches. On distingue ainsi les chlorophylles a, b, c et d ainsi que quelques dérivés apparentés. Les chlorophylles a et b sont les plus abondantes chez les plantes supérieures et algues vertes, en proportions variables suivant l’espèce. Les chlorophylles c et d sont plutôt présentes chez les algues brunes et cyanobactéries.
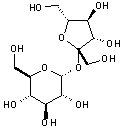
Les chlorophylles sont des molécules dont le squelette de base est celui d'un noyau de chlorine (un dérivé de la famille des porphyrines) au centre duquel est fixé (complexé) un ion magnésium Mg2+ grâce aux doublets non-liants des atomes d'azote. À la périphérie du noyau se trouve une chaîne carbonée. Les chlorophylles a et b ne diffèrent que d’un groupement chimique (méthyle -CH3 pour la chlorophylle a et aldéhyde -CHO pour la b) sur le noyau de chlorine.
Toutes les plantes vertes contiennent les chlorophylles, certaines en possédant une forte concentration dans les feuilles, comme les épinards d’où nous allons l’extraire. Cependant l’extraction peut tout à fait être réalisée à partir d’autres plantes, même de l’herbe (bien verte… oubliez votre pelouse jaune lors de la canicule) !
Nous procéderons ensuite à une rapide identification des différentes substances de l'extrait de plante, que nous séparerons par chromatographie liquide sur colonne.
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Les chlorophylles pures ne sont pas spécialement dangereuses, cependant on veillera à toujours les manipuler avec des gants.
- Le dichlorométhane
 est un solvant suspecté d'être cancérogène. Il sera donc manipulé sous hotte avec l’équipement de protection habituel (blouse, gants et lunettes).
est un solvant suspecté d'être cancérogène. Il sera donc manipulé sous hotte avec l’équipement de protection habituel (blouse, gants et lunettes). - L’éthanol
 n’est pas un solvant dangereux à manipuler. Cependant, son caractère inflammable exclue sa manipulation à proximité de toute source d’ignition (étincelles, flammes, sources de chaleur). Respirer ses vapeurs est à exclure pour ne pas être soûl.
n’est pas un solvant dangereux à manipuler. Cependant, son caractère inflammable exclue sa manipulation à proximité de toute source d’ignition (étincelles, flammes, sources de chaleur). Respirer ses vapeurs est à exclure pour ne pas être soûl. - L’éther diéthylique

 est un solvant très inflammable et volatil. Toute source d’ignition doit absolument être évité. De plus, en raison de son caractère nocif, il devra être manipulé avec des gants et sous hotte.
est un solvant très inflammable et volatil. Toute source d’ignition doit absolument être évité. De plus, en raison de son caractère nocif, il devra être manipulé avec des gants et sous hotte. - L’éther de pétrole


 est un mélange d’alcanes présentant un point d’ébullition compris entre 40 et 60°C (selon les qualités). Il est inflammable et nocif et sera donc manipulé sous hotte avec gants.
est un mélange d’alcanes présentant un point d’ébullition compris entre 40 et 60°C (selon les qualités). Il est inflammable et nocif et sera donc manipulé sous hotte avec gants. - L’utilisation d’une lampe à ultraviolet nécessite des protections. Utiliser des lunettes protectrices prévues à cet effet, ne pas regarder directement la source lumineuse et limiter la durée de l’exposition.
2 Extraction
2.1 Matériel et produits
- Mortier et pilon
- Sable
- Filtre + entonnoir
- Ballon
- Plante verte (épinards ou autre)
- Solvant d’extraction : éthanol
 , éther diéthylique
, éther diéthylique 
 ou dichlorométhane
ou dichlorométhane 
2.2 Protocole [2]
- Coupez les feuilles d’épinard de façon grossière avec une paire de ciseaux.
- Placez les feuilles coupées dans un mortier avec un peu de sable (qui facilite le broyage) et rajouter l’un des solvants suivant : éthanol, éther diéthylique ou dichlorométhane.
- Broyer les feuilles jusqu’à ce que le solvant prenne une teinte verte marquée.
 Feuilles d'épinard coupées, dans un mortier, avec sable et solvant. |
 Après broyage. |
- Filtrer le broyat sur papier filtre ou, mieux, sur filtre de type Büchner avec une fiole à vide. Le filtrat (le liquide) obtenu doit être d’un vert limpide.
- Évaporer le solvant à l’évaporateur rotatif ou alors en chauffant modérément au bain-marie. L’évaporation peut alors être accélérée en soufflant un peu d’air à la surface de la solution à l’aide d’une pompe à air pour aquarium. On obtient une pâte verte foncée.
 Filtrat après broyage des épinards. |
 Après évaporation du filtrat : mélange de chlorophylles. |
3 Identification
3.1 Matériel et produits
- Plaque pour CCM
- Cuve de chromatographie (pot à confiture)
- Tube capillaire
- Éther diéthylique


- Éther de pétrole



- Dichlorométhane

3.2 Protocole
La pâte verte foncée obtenue par évaporation du solvant d’extraction contient différentes molécules, notamment les chlorophylles a et b. L’analyse sommaire de ce mélange peut-être réalisée par chromatographie sur couche mince (CCM) en utilisant comme éluant le mélange suivant de solvants : éther de pétrole/éther diéthylique (40/60 en volume) ![]()
![]()
![]() . Pour cela, on se sert d’une plaque CCM (plaque d'aluminium recouverte d’une fine couche de silice).
. Pour cela, on se sert d’une plaque CCM (plaque d'aluminium recouverte d’une fine couche de silice).
- Tracez un point au milieu de la plaque, à environ 1 cm du bord inférieur, au crayon de papier, sans abîmer la couche de silice.
- Dissoudre la pâte verte obtenue précédemment dans quelques mL de dichlorométhane
 .
. - Trempez la pointe d’un capillaire (ou d’une fine pipette) dans la solution verte et déposez une micro-goutte de solution sur la croix. Laisser sécher et renouveler le dépôt. Le fait de faire plusieurs dépôts superposés a pour effet de concentrer le tache et donc augmenter l'intensité des couleurs après chromatographie.
- Placez l’éluant dans un récipient à fond plat, fermant avec un couvercle (le pot à confiture est tout à fait indiqué) sur une hauteur d’environ 0,5 cm.
- Déposez délicatement la plaque CCM dans la cuve et laissez le solvant monter par capillarité jusqu’à environ 1 cm du bord supérieur. Il est important de ne pas bouger le flacon jusqu'à la fin de l'élution !
- Sortez la plaque et marquez le front de l'éluant à l’aide d’un trait au crayon de papier, c'est à dire l’endroit où s’est arrêté le solvant.
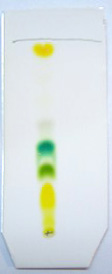
- Observez les différentes taches sur la plaque CCM.
- Analyse de la plaque :
- En haut de la plaque, on remarque une tache jaune constituée de molécules connues sous le nom de carotènes
- Puis vient une tache de couleur vert-bleu correspondant à la chlorophylle a.
- Puis une tache de couleur vert-jaune correspondant à la chlorophylle b.
- Enfin, deux taches jaunes constituées de xanthophylles (violaxanthine et néoxanthine).
Nous mettons ainsi, de façon simple, en évidence la présence de plusieurs molécules différentes dans l’extrait d’épinard. Puisque la CCM permet une séparation de ces molécules, nous allons transposer cette technique à plus grande échelle pour séparer mais aussi récupérer les différentes fractions du mélange, grâce la chromatographie liquide sur colonne.
4 Purification par chromatographie sur colonne
4.1 Matériel et produits
- Colonne de chromatographie (ou burette graduée)
- Coton
- Sable grossier
- Sable de Fontainebleau (sable fin)
- Sucre glace
- Pipette
- Erlenmeyer ou autre récipient en verre d’environ 100 mL
- Éther diéthylique


- Éther de pétrole



4.2 Protocole
Nous allons séparer et récupérer les différents constituants de l’extrait d’épinard grâce à la chromatographie liquide sur colonne. Cette technique de purification peut sembler difficile à mettre en œuvre la première fois, mais en respectant bien les différentes étapes décrites, réussir la purification est loin d’être si complexe que ça. Nous verrons ici la purification avec du sable de Fontainebleau et, chose rare, du sucre glace !
La chromatographie liquide sur colonne (CLC) nécessite l’emploi d’une colonne de verre, d’une longueur d’une trentaine de centimètres, si possible munie d’un robinet à son extrémité inférieure. Si la colonne n’a pas de robinet, on peut fixer à son extrémité un tuyau muni d’une pince de Mohr.
4.2.1 Préparation de la colonne
- Préparer 400 mL d’éluant : mélange de solvants éther de pétrole/éther diéthylique (60/40 en volume)



- Fixez la colonne en deux points à un support fixe.
- Remplir la colonne de sable de Fontainebleau sur environ 20 cm de hauteur.
- Videz la colonne dans un bécher de 400 mL.
- Replacez la colonne sur son support et placer un peu de coton en bas de colonne puis le recouvrir d’une couche d’environ 1 cm de sable.
- Ajoutez environ 10 cm de l’éluant et chassez les bulles d’air en tapotant légèrement la colonne à l’aide d’un objet quelconque en caoutchouc (une gomme fait très bien l’affaire).
- Ajoutez environ 200 mL d’éluant dans le bécher contenant le sable. Bien agiter pour obtenir un gel un peu visqueux.
- Versez doucement ce gel dans la colonne. Chassez les bulles d’air en tapotant la colonne.
- Rajoutez si besoin de l’éluant dans la colonne de façon à ce que le haut de la couche de sable ne soit jamais sec. Laisser environ 2 cm de solvant au-dessus du sable de Fontainebleau.
- Déposez doucement environ 1 cm de sable grossier sur le sable de Fontainebleau.
4.2.2 Chromatographie sur colonne de sable [3]
- Laissez le solvant s’écouler jusqu’à atteindre la couche de sable grossier.
- Prélever la solution d’extrait d’épinard dans le dichlorométhane à l’aide d’une pipette et la déposez goutte à goutte sur tout le pourtour interne de la paroi. Ne pas déposer la solution directement sur le sable.
- Laissez s’écouler un peu de solvant pour faire pénétrer l’extrait dans le sable.
- Rajoutez à la pipette (toujours sur le pourtour de la colonne) de l’éluant propre.
- Laisser couler le solvant en en rajoutant régulièrement de l’éluant en haut de colonne afin que celle-ci ne soit jamais sèche.
- Observez les couleurs qui semblent avancer sur le sable.
- Récupérer les différentes fractions dans des erlenmeyers, ou tout récipient en verre, en fonction de la couleur du coton en bas de colonne. On obtient ainsi les carotènes, la chlorophylle a, la chlorophylle b et les xanthophylles.
- En évaporant une partie du solvant, on obtient des solutions concentrées de ces molécules.
4.2.3 Chromatographie sur colonne de sucre [4]
- Préparez la colonne de la même façon que précédemment en remplaçant le sable de Fontainebleau par du sucre glace.
- Déposez l’extrait et réalisez l’élution comme précédemment.
- On peut donc de la même façon que précédemment récupérer les différentes fractions composant l’extrait dans des récipients en verre. On retrouve les carotènes (jaune), les chlorophylles a et b (respectivement vert-bleu et vert-jaune) et la violaxanthine (jaune, très peu visible sur le sucre). Et ceci grâce à du sucre glace.
5 Explications
5.1 Plusieurs couleurs pour un même composé !
- En plaçant l’extrait de plante dans quelques mL d’éthanol, on remarque que la couleur de la solution dépend de l'angle de vue par rapport à une source lumineuse :
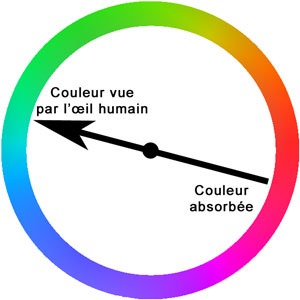
- Vue par transparence à la lumière du jour, c'est bien la couleur verte que nous observons. La couleur verte de la chlorophylle (et donc des feuilles) vient du fait que la molécule absorbe essentiellement dans la zone de couleur complémentaire, c'est à dire le magenta. (L'expérience sur le jus de chou rouge pour d'autres explications.)
- Vue par réflexion (source de lumière dans votre dos), la solution semble être d'une autre couleur, plus rouge. Il s'agit ici du phénomène de fluorescence, c'est à dire d'une absorbtion de la lumière suivi d'une réémission instantannée de lumière. Pour plus d'explications, se reporter à la page fluorescence et phosphorescence. Cette couleur rouge peut être mise en évidence plus facilement en éclairant la solution obtenue avec des ultraviolets (UV) :
La même expérience peut être réalisée sur les différentes fractions après chromatographie :
Les carotènes ne sont pas fluorescents et les xanthophylles ne le sont que très peu, du moins dans la longueur d'onde utilisée ici.
5.2 Extraction et séparation
Les solvants employés lors de l’extraction ne dissolvent pas que les chlorophylles mais également d’autres pigments. Pour obtenir les chlorophylles pures, il faut séparer le mélange par chromatographie.
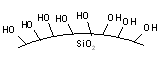
Cette technique est basée sur les différentes interactions entre une molécule, un support solide et un solvant. Le solide est du sable, donc de la silice qui présente à sa surface de nombreux groupes hydroxyles (-OH) qui vont interagir avec les molécules dissoutes dans un solvant. Le sucre en poudre (saccharose) peut jouer le même rôle en raison de ses nombreux groupes hydroxyles disponibles.
Plus la molécule sera polaire et présentera d’atomes d’oxygène, plus elle pourra se lier avec les groupes hydroxyles du support et donc plus elle sera difficilement entraînée par le solvant.
En comparant les structures des différents composés du mélange, on peut justifier leur ordre de séparation :
- Les carotènes, tels que le lycopène et le β-carotène [5] : ce sont des composés globalement apolaires, ne présentant pas d’atome d’oxygène, qui ne sont pas retenus par le support.
- Les chlorophylles a et b : ce sont des composés peu polaires, la chlorophylle b présentant un groupe aldéhyde -CHO qui va se lier avec le support. Ce qui explique que les deux chlorophylles puissent être séparées.
Il est également possible de séparer les chlorophylles a et b en se basant sur leur différence de solubilités dans différents solvants organiques [6]. Cette méthode demande cependant des quantités importantes de solvants.
- Les xantophylles (violaxanthine et néoxanthine) : ce sont des composés polaires présentant de nombreux atomes d’oxygènes qui vont pouvoir se lier avec le support solide. Ces composés sortiront donc en dernier de la colonne.
- De par sa complexité structurale, les chlorophylles ont été des cibles de choix pour les chimistes de synthèse. En 1960, le célèbre chimiste Robert Woodward achève avec son équipe la toute première synthèse totale de la chlorophylle a, après 4 années de travail intensif [7][8][9].
5.3 Quand l’automne arrive...
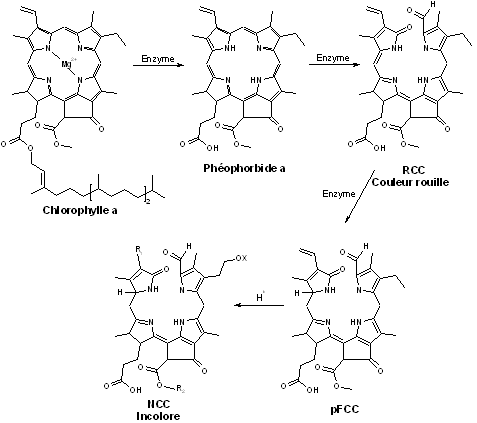
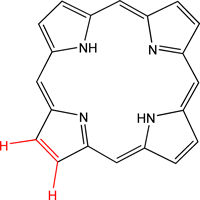
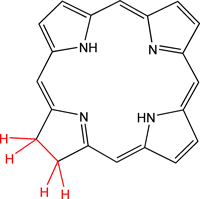
À l’automne, les feuilles des arbres perdent leur teinte verte de l’été pour des couleurs allant du jaune au rouge sombre. Ce changement de couleur est du à la dégradation des chlorophylles a et b. [10][11] Ainsi, sous l’action d’enzymes, la chlorophylle verte va être transformée en des molécules tout d’abord rouges puis incolores. Les autres pigments de la plante (telles les caroténoïdes) ne seront plus cachés par le vert de la chlorophylle et ce sont eux qui seront responsables des couleurs jaunes que va prendre la feuille. Les réactions de dégradation de la chlorophylle sont :
6 Pour en savoir plus
- Voir : Les porphyrines
- Wikipédia - Chlorophylle : http://fr.wikipedia.org/wiki/Chlorophylle
- Wikipédia - Chloroplaste : http://fr.wikipedia.org/wiki/Chloroplaste
- Wikipédia - Carotène : http://fr.wikipedia.org/wiki/Carotène
- Wikipédia - Vitamine B12 : http://fr.wikipedia.org/wiki/Vitamine_B12
- Une expérience de photographie à la chlorophylle : les anthotypes
7 Références
- Aller ↑ Brown S.B., Houghton J.D., Hendry G.A.F. ; Chlorophyll Breakdown, dans Chlorophylls, 1991, p 465, CRC Press.
- Aller ↑ Marie Terrien, Josette Fournier, Chimie du petit déjeuner, Cultures et Techniques (1998)
- Aller ↑ Lalitha N. ; Journal of Chemical Education, 71, 432 (1994)
- Aller ↑ Strain H.H. ; Ann. Priestley Lectures, 32 (1958)
- Aller ↑ Capon M., Courilleau V., Valette C. ; Chimie des couleurs et des odeurs, Cultures et Techniques (1993)
- Aller ↑ Lebeau P., Janot M.M. ; Traité de pharmacie chimique – Tome V, p. 3733, Masson et Cie (1955)
- Aller ↑ Woodward R.B. and coll. ; Pure Appl. Chem., 2, 383 (1961)
- Aller ↑ Woodward R.B. and coll. ; Angew. Chem., 72, 651 (1960)
- Aller ↑ Woodward R.B. and coll. ; J. Am. Chem. Soc., 82, 3800 (1960)
- Aller ↑ Kräutler B., Matile P. ; Acc. Chem. Res., 32, 35 (1999)
- Aller ↑ Oberhuber M., Berghold J., Breuker K., Hörtensteiner S., Kraütler B., PNAS, 100, 6910 (2003)
- Ouvrage complet sur le sujet : The Chlorophylls, L. P. Vernon, G. R. Seely ; Academic Press (1966)
Merci à William Erb pour son travail de synthèse pour cette page et ses photographies.