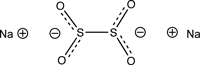
Dithionite de sodium
Un article du site scienceamusante.net.
(Redirigé depuis Hydrosulfite de sodium)

|
| GHS02 |

|
| GHS07 |
- Formule brute : Na2S2O4
- Autre dénomination : hydrosulfite de sodium
- Ne pas confondre avec : thiosulfate de sodium Na2S2O3, disulfite de sodium Na2S2O5, bisulfite de sodium ou hydrogénosulfite de sodium NaHSO3. Attention : il y a souvent des confusions entre ces produits !
- N°CAS : 7775-14-6
- N°CE : 231-890-0
Sommaire
[masquer]1 Propriétés physiques[1]
- Masse molaire : 174,108 g/mol
- Densité : 2,19
- Température de décomposition : 52°C
- Solubilité :
- Eau : 241 g/L (20°C)
- Éthanol : légèrement soluble
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
- Substances et mélanges auto-échauffants, catégorie 1
- Toxicité aiguë par voie orale, catégorie 4
![]()
![]() Danger
Danger
- H251 : Matière auto-échauffante ; peut s’enflammer.
- H302 : Nocif en cas d’ingestion.
- EUH031 : Au contact d'un acide, dégage un gaz toxique.
| Voir / adapter / imprimer cette étiquette |
3 Préparation
Par action de l'hydrogénosulfite de sodium en solution sur le zinc ![]()
![]() :
:
- 2 NaHSO3(aq) + Zn(s) → Na2S2O4(aq) + Zn(OH)2(s)
- Mettre un excès de zinc en poudre.
- Après réaction, filtrer pour éliminer le zinc et le précipité d'hydroxyde de zinc.
- Laisser évaporer doucement le filtrat, sans chauffer (car il se décompose dans l'eau chaude).
4 Réactivité, conservation
Le dithionite de sodium doit être conservé à l'abri de l'humidité et du dioxygène de l'air. En effet, il s'oxyde à l'air humide en hydrogénosulfite de sodium ainsi :
- 2 Na2S2O4(s) + O2(g) + 2 H2O(g) → 4 NaHSO3(s)
et ce dernier réagit avec le dioxyde de carbone de l'air en libérant du dioxyde de soufre ![]()
![]() irritant et de l'hydrogénocarbonate de sodium selon :
irritant et de l'hydrogénocarbonate de sodium selon :
- NaHSO3(s) + CO2(g) → NaHCO3(s) + SO2(g)
En présence d'eau, l'ion dithionite se décompose en thiosulfate et hydrogénosulfite (bisulfite) :
- 2 S2O42− + H2O → S2O32− + 2 HSO3−
5 Références
- Aller ↑ CRC Handbook of Chemistry and Physics, David R. Lide, 88th edition (2007-2008). ISBN 978-0-8493-0488-0