Dorure d'une clé par électrolyse
Voici une méthode électrochimique pour déposer une fine couche brillante d'or métallique sur un objet. Cette technique est aussi appelée "électrodéposition" ou "dorure galvanique". Elle peut être appliquée à toutes sortes d'objets conducteurs de l'électricité, tels qu'une clé en nickel, un bijou en argent ou en cuivre, etc.
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- L'eau régale

 est un mélange très corrosif. Bien se protéger le visage et les mains.
est un mélange très corrosif. Bien se protéger le visage et les mains. - Éloigner les animaux domestiques et les enfants ! Renverser un bécher contenant l'équivalent de 100 € d'or est si vite arrivé...
2 Matériel et produits
- Chlorure d'or (III) AuCl3
 (ou bien HAuCl4)
(ou bien HAuCl4) - Si AuCl3 ou HAuCl4 n'est pas disponible, utiliser un peu d'or métallique et de l'eau régale

 . Étant donné le prix du chlorure d'or chez les vendeurs de produits pour laboratoire[1], il est préférable de récupérer des petits bouts d'or, même en alliage (si l'alliage contient du cuivre, l'attaque à l'eau régale forme du chlorure de cuivre qui ne gêne pas la suite des opérations).
. Étant donné le prix du chlorure d'or chez les vendeurs de produits pour laboratoire[1], il est préférable de récupérer des petits bouts d'or, même en alliage (si l'alliage contient du cuivre, l'attaque à l'eau régale forme du chlorure de cuivre qui ne gêne pas la suite des opérations). - Un générateur électrique continu de tension de quelques volts (une pile électrique de 4,5 V peut être suffisante). Ne pas utiliser un générateur alternatif.
- Un ampèremètre et un voltmètre, si possible.
- Un bécher
- Une ou plusieurs électrodes de graphite (ou de platine).
- Alcool éthylique
 , acétone
, acétone 
 ou autre solvant volatil.
ou autre solvant volatil.
3 Préparation de l'objet que l'on souhaite métalliser
Il est indispensable de bien nettoyer et dégraisser l'objet métallique sur lequel on souhaite déposer la fine couche d'or, car les bijoux, pièces, clés, etc. passent de main en main, trainent dans les poches et se salissent... La couche de saleté peut rendre le dépôt métallique inhomogène.
- Porter des gants de manière à ne pas toucher l'objet directement avec la peau.
- À l'aide d'un chiffon ou d'un papier essuie-tout et d'un solvant (éthanol de pharmacie, alcool à brûler, acétone ou éther éthylique), frotter toutes les parties de l'objet. Pour les endroits difficiles d'accès utiliser un coton-tige. (Attention à ne pas respirer les vapeurs de solvant et ne pas manipuler près d'une flamme ou d'une source de chaleur.)
4 Préparation de l'électrolyte (solution contenant l'or sous forme ionique)
Plusieurs possibilités, selon les produits à disposition.
4.1 À partir d'un morceau d'or métallique
- L'or est un métal très résistant aux attaques des acides. Le seul acide capable de le dissoudre est l'eau régale

 , un mélange d'acides chlorhydrique et nitrique concentrés, très corrosif et instable. Ce mélange d'acide ne doit être préparé qu'au moment de l'expérience ; éviter de le conserver plus longtemps car il se décompose avec le temps.
, un mélange d'acides chlorhydrique et nitrique concentrés, très corrosif et instable. Ce mélange d'acide ne doit être préparé qu'au moment de l'expérience ; éviter de le conserver plus longtemps car il se décompose avec le temps. - Récupérer un petit morceau d'or métallique (fragment de chaîne, bague, de dent en or...) : 0,5 g est suffisant pour la suite, pour recouvrir une clé, par exemple.
- Dans un bécher en verre, placer l'or et verser 1 mL d'eau régale. Après cette première attaque, laquelle dégage des vapeurs corrosives qu'il ne faut pas respirer, s'il reste encore de l'or métallique, ajouter un 1 mL d'eau régale. Ainsi de suite jusqu'à ce que tout le métal soit dissout.
- Il est possible de porter la solution à légère ébullition, sur plaque chauffante, pour éliminer l'excès d'acide. Ne pas respirer les vapeurs acides !
- Diluer avec de l'eau distillée et verser dans un bécher de 100 mL. Ceci constitue la solution aqueuse contenant des ions Au3+, qui servira d'électrolyte.
4.2 À partir d'un sel d'or
Si l'on dispose directement de chlorure d'or (III) AuCl3 ![]() (ou de HAuCl4), alors il suffit de réaliser la solution suivante[2] :
(ou de HAuCl4), alors il suffit de réaliser la solution suivante[2] :
- Dissoudre 0,6 g de sel d'or dans 100 mL d'eau distillée.
- Ajouter une solution formée en dissolvant 3 g de ferricyanure de potassium K3Fe(CN)6, et 3 g de carbonate de potassium K2CO3 (ou de Na2CO3
 ) dans 100 mL eau. Il se forme un dépôt brun peu attirant : c'est le seul désavantage de cette méthode. Il ne faut pas l'éliminer. Son existence est essentielle.
) dans 100 mL eau. Il se forme un dépôt brun peu attirant : c'est le seul désavantage de cette méthode. Il ne faut pas l'éliminer. Son existence est essentielle.
Les composés ajoutés ici servent d'agents de brillance : en effet, l'utilisation d'ions Au3+ seuls donnerait un dépôt d'or irrégulier d'aspect terne. La complexation avec le ferricyanure évite la formation d'agrégats d'or et favorise une répartition homogène des atomes d'or sur la surface de l'objet : l'aspect sera brillant. En industrie, les bains électrolytiques contiennent souvent des ions cyanures très toxiques ou des additifs gardés secrets par les industriels ; l'utilisation de ferricyanure est bien moins dangereux.
5 Préparation de la cuve, position des électrodes
- Il faut un récipient en verre assez grand pour pouvoir y tremper l'objet (qui constitue la cathode) et placer les électrodes en graphite ou en or (qui constituent l'anode). Schémas de montages possibles :
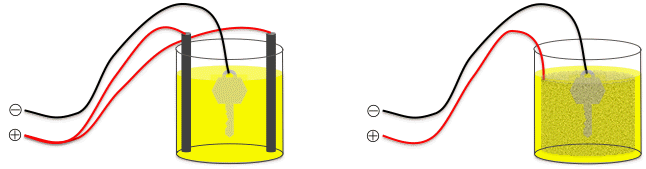
- L'anode est reliée à la borne positive du générateur et peut être, au choix :
- un treillis de platine enroulé en cylindre (mais le platine vaut une petite fortune...),
- des électrodes en graphite (ou "charbon"), c'est-à-dire en carbone conducteur de l'électrique (grosses mines de crayon), réparties autour de l'objet,
- des électrodes en or (fil ou objet en or) ; l'avantage ici est qu'au fur et à mesure que les ions Au3+ sont consommés lors du dépôt, ils sont recréés par attaque de l'anode en or. (Ceci n'est utile que si l'on souhaite faire un plaquage d'or sur un grand nombre d'objets.)
- ne pas utiliser d'autres métaux en guise d'anode, car alors ceux-ci seraient oxydés en ions qui viendraient polluer l'électrolyte...
- La cathode est reliée à la borne négative du générateur, elle est constituée de l'objet qui a été décapé dans la première opération. On peut utiliser une pince crocodile pour suspendre l'objet dans la solution, ou bien un fil de cuivre. L'objet suspendu doit être situé à peu près à égale distance des anodes qui l'entourent, afin que le dépôt d'or puisse se faire de manière homogène. En utilisant une seule anode, on risque d'avoir un dépôt d'or inexistant du côté de l'objet qui n'est pas en face de l'anode.
Une fois les électrodes en place, verser la solution d'électrolyte. Les électrodes doivent bien tremper ; l'objet doit être immergé, soit entièrement, soit à moitié (et dans ce cas, il faudra réaliser l'électrodéposition une deuxième fois, pour la partie hors de la solution).
Une astuce pour éviter un possible court-circuit consiste à placer, entre l'objet et l'anode, un gobelet en plastique dans lequel des trous auront été fait à l'aide d'une pointe chauffée.
Surtout ne pas inverser les bornes du générateur par erreur, car alors ce serait le métal de l'objet qui passerait sous forme d'ions en solution ! L'objet serait corrodé, les ions souilleraient l'électrolyte, et l'or se déposerait sur les électrodes en graphite.
6 Electrodéposition, réglage du générateur
Pour réaliser un beau dépôt, il ne faut pas être pressé ! Compter 10 à 15 min pour un objet.
- La tension électrique du générateur doit être entre 4,5 et 6 V.
- L'intensité du courant électrique ne doit pas être trop élevée : compter 10 mA par cm2 de surface à métalliser. Par exemple pour une clé de maison en nickel, on peut estimer la surface totale à 4 ou 5 cm2, il faudra donc ajuster l'intensité entre 40 et 50 mA à l'aide d'une résistance variable placée en série. Le dégagement de gaz à l'anode doit être minimum, à peine visible. On peut utiliser une feuille de papier quadrillé en cm pour estimer la surface totale d'un objet. Ne pas oublier de compter les deux faces et les surfaces de l'épaisseur de la clé.
- La réaction électrochimique à la cathode est la suivante :
- Au3+(aq) + 3 e– → Au(s) E°Au3+/Au = 1,498 V
- Après 5 min, observer le dépôt : si celui-ci est vert, c'est le signe que le système fonctionne ; la couche d'or déposée est très fine, ne pas toucher le dépôt.
- Au bout de 10 min environ, la clé est visiblement dorée avec une belle couleur jaune brillante.
- Au bout de 15 min environ, la clé est dorée avec une belle couleur jaune-orangée d'or, signe que la couche déposée est plus épaisse. Rincer à l'eau distillée et essuyer délicatement l'objet.

La dorure tient des mois, mais finit par s'user à force d'être frottée.
Il a été observé que la solution d'électrolyte prenait une couleur vert à bleu foncé après avoir réalisé plusieurs l'électrodépositions avec divers objets ; cela ne semble pas perturber le déroulement de l'expérience.
7 Quelques calculs
On peut se demander quelle quantité d'or a été déposée sur la clé, quelle épaisseur de dorure cela représente, et quel coût.
Avec une intensité du courant électrique de 0,05 A, et une durée de déposition de 10 min, on calcule la quantité de charges électriques qui ont circulé :
- Q = I × t = 0,05 × (10 × 60) = 30 C
- (Puisque 1 A = 1 C/s)
Or, une mole d'électrons représente une charge électrique égale à la constante de Faraday : F ≈ 96500 C/mol. Ce qui fait que la quantité d'électrons qui ont circulé pendant la déposition est égale à :
- ne = 30 / 96500 = 0,00031 mol
Vu qu'il faut 3 électrons à chaque transformation de Au3+ vers Au0, la quantité d'or déposé est :
- nAu = 0,00031 / 3 = 0,000104 mol
D'où la masse d'or (sachant que MAu = 197 g/mol) :
- mAu = 0,000104 × 197 = 0,0204 g
Sachant que la masse volumique de l'or est de 19,3 g/cm3, le volume d'or déposé est :
- VAu = 0,0203 / 19,3 = 0,00106 cm3
Sachant que la surface de la clé est estimée à 5 cm2, l'épaisseur de la couche d'or est d'environ :
- E = 0,00106 / 5 = 0,00021 cm = 2,1 µm
Le prix de l'or étant d'environ 45 €/g (à l'instant où cette page est rédigée), la clef a pris une valeur d'environ 0,92 €.