Diazote
Un article du site scienceamusante.net.
- Formule brute : N2
- Ne pas confondre avec : azote liquide
- N°CAS : 7727-37-9
- N°CE : 231-783-9
Sommaire
[masquer]1 Propriétés physiques
- Masse molaire : 28,01 g/mol
- Température de fusion : –210°C
- Température d'ébullition : –195,79°C
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
![]() Attention
Attention
- H280 : Contient un gaz sous pression ; peut exploser sous l’effet de la chaleur.
3 Caractérisation
- Le diazote est un gaz relativement inerte, ni comburant, ni combustible, ni corrosif. Il est présent dans l'air à environ 80% (et environ 20% de dioxygène
 ). Une baguette en bois enflammée s'éteint si elle est introduite dans un récipient contenant le diazote, tout comme le dioxyde de carbone CO2 mais le diazote ne trouble pas l'eau de chaux.
). Une baguette en bois enflammée s'éteint si elle est introduite dans un récipient contenant le diazote, tout comme le dioxyde de carbone CO2 mais le diazote ne trouble pas l'eau de chaux.
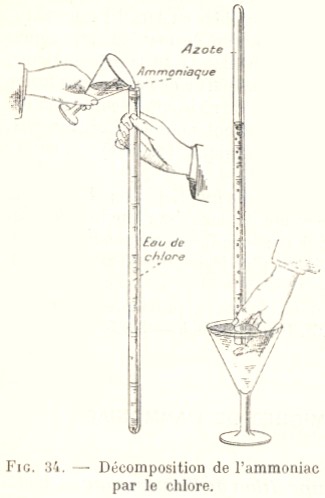
4 Synthèses
- Par action de l'eau de chlore
 sur l'ammoniac
sur l'ammoniac 

 .
. - Méthode de Ramsay datant de 1896 :
- Préparer une solution saturée de nitrite de sodium NaNO2


 (815 g/L), et une solution saturée de chlorure d'ammonium NH4Cl
(815 g/L), et une solution saturée de chlorure d'ammonium NH4Cl  (360 g/L).
(360 g/L). - Mélanger un même volume des deux solutions dans un ballon de volume double et chauffer.
- Des bulles de diazote se forment. Il se passe la réaction suivante :
- Préparer une solution saturée de nitrite de sodium NaNO2
- NaNO2(aq) + NH4Cl(aq) → NaCl(aq) + 2 H2O(l) + N2(g)
- Par action du nitrite de sodium


 sur l'acide sulfamique[1] :
sur l'acide sulfamique[1] :
- Dans un ballon bicol rodé, placer 2 g d'acide sulfamique HSO3NH2.
- Préparer 50 mL une solution de nitrite de sodium NaNO2 à 0,5 mol/L et la placer dans une ampoule de coulée sur l'un des cols.
- Sur l'autre col, relier un tube flexible qui servira à récupérer le diazote dans un récipient rempli d'eau retourné sur une bassine d'eau.
- Faire couler goutte à goutte la solution dans le ballon. La réaction est :
- NaNO2(aq) + HSO3NH2(s) → NaHSO4(aq) + H2O(l) + N2(g)
5 Références
- Wikipédia, diazote : http://fr.wikipedia.org/wiki/Diazote