Dioxyde de soufre
Un article du site scienceamusante.net.
(Redirigé depuis Anhydride sulfureux)

|
| GHS04 |

|
| GHS08 |

|
| GHS06 |
|
| GHS05 |
- Formule brute : SO2
- Autres dénominations : anhydride sulfureux
- Ne pas confondre avec : anhydride sulfurique
- N°CAS : 7446-09-5
- N°CE : 231-195-2
Sommaire
[masquer]1 Propriétés physiques[1]
- Masse molaire : 64,064 g/mol
- Température de fusion : –75,5°C
- Température d'ébullition : –10,05°C
- Aspect : à température et pression ambiantes, le dioxyde de soufre est un gaz à odeur piquante désagréable.
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
- Gaz sous pression
- Toxicité aiguë par inhalation, catégorie 3
- Toxicité spécifique pour certains organes cibles - Exposition unique, catégorie 1
- Corrosion cutanée/irritation cutanée, catégorie 1B
![]()
![]()
![]()
![]() Danger
Danger
- H331 : Toxique par inhalation.
- H370 : Risque avéré d’effets graves pour les organes (système respiratoire, inhalation).
- H314 : Provoque de graves brûlures de la peau et de graves lésions des yeux.
3 Préparation
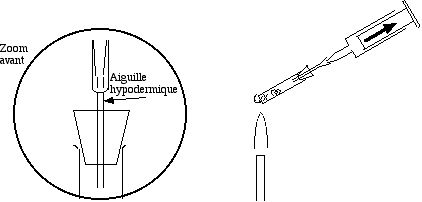
La méthode suivante permet de préparer SO2 sans gêne de l'odeur, mais elle exige un petit matériel qu'il faut fabriquer à l'avance, à base de seringues hypodermiques en plastique :
- Remplir au quart un petit tube à combustion avec l'un des produits suivants, au choix :
- Métabisulfite de sodium Na2S2O5

 , hydraté ou non
, hydraté ou non - Hydrogénosulfite de sodium NaHSO3
 , hydraté ou non
, hydraté ou non
- Métabisulfite de sodium Na2S2O5
- Recouvrir la poudre choisie avec un peu de laine de verre (pas indispensable).
- Fermer le tube avec un bouchon de caoutchouc percé par une aiguille hypodermique. Y adapter une seringue de 10 ou 20 mL en plastique.
- Prendre en main la seringue, ainsi “prolongée” par le tube contenant la poudre. Chauffer doucement le tube dans la flamme d'un chalumeau. Il va se dégager le SO2 gazeux qui repousse le piston.
- Il se produit l'une des réactions suivantes :
- Na2S2O5(s) → Na2SO3(s) + SO2(g)
- 2 NaHSO3(s) → Na2SO3(s) + SO2(g) + H2O
- Le gaz dégagé remplit peu à peu la seringue plastique. Quand elle est presque pleine de gaz, l'enlever de l'aiguille, la poser sur la table, et replacer une 2ème seringue, qui se remplit à son tour.
- Il n'est pas nécessaire de boucher la pointe des seringues. Le gaz ne diffuse que très lentement hors de la seringue.
4 Réactions
- Le dioxyde de soufre réagit avec le dioxygène
 pour former du trioxyde de soufre
pour former du trioxyde de soufre 
 , selon :
, selon :
- 2 SO2(g) + O2(g) → SO3(g)
- Le dioxyde de soufre en présence d'eau forme l'acide sulfureux

 :
:
- SO2(g) + H2O(l) → H2SO3(aq)
5 Références
- Aller ↑ CRC Handbook of Chemistry and Physics, David R. Lide, 88th edition (2007-2008). ISBN 978-0-8493-0488-0
Merci à Maurice Cosandey pour cette contribution.