Analyse qualitative des ions
Sommaire
[masquer]- 1 Analyse qualitative des ions en solution aqueuse
- 1.1 Introduction
- 1.2 Anions : Cl–, Br–, NO3–, SO42–
- 1.3 Anion phosphate : PO43–
- 1.4 Cations du groupe I : Ag+, Hg22+, Pb2+
- 1.5 Cations du groupe II : Sn2+, Sn4+, Sb3+, Cu2+, Hg2+
- 1.6 Cations du groupe III : Fe2+, Fe3+, Al3+, Cr3+
- 1.7 Cations du groupe IV : Mn2+, Ni2+, Co2+
- 1.8 Cations du groupe V : Ba2+, Ca2+
- 1.9 Cations du groupe VI : Mg2+
- 1.10 Cation potassium K+
- 1.11 Tests complémentaires
- 2 Réactifs pour analyse
- 3 Références
1 Analyse qualitative des ions en solution aqueuse
1.1 Introduction
Dans les organigrammes suivants, les notations suivantes sont utilisées :
- LP : liqueur primitive, c'est la solution dans laquelle on veut tester la présence des ions.
- LF : liqueur fille, c'est une solution obtenue après opérations sur la LP, qui est utilisée pour poursuivre les tests.
- PP : précipité, c'est à dire un solide en suspension dans la solution, suite à une réaction.
- Il est conseillé de verser l'acide sulfurique
 avant le permanganate de potassium
avant le permanganate de potassium 

 ou l'iodure de potassium pour ne pas confondre le changement de couleur avec la formations possible d’un précipité dû à l'acide.
ou l'iodure de potassium pour ne pas confondre le changement de couleur avec la formations possible d’un précipité dû à l'acide.
1.2 Anions : Cl–, Br–, NO3–, SO42–
On trouve dans ce groupe les anions :
- Chlorure Cl–
- Bromure Br–
- Nitrate NO3–
- Sulfate SO42–
Remarques :
- Si la solution contient Pb2+, Ba2+, Ca2+, l’addition d'acide sulfurique H2SO4
 provoque un précipité. Mettre alors l'acide sulfurique
provoque un précipité. Mettre alors l'acide sulfurique  en excès.
en excès. - La présence d'ions chlorure Cl– est incompatible avec la présence de cations du groupe I : Pb2+, Hg22+, Ag+.
1.3 Anion phosphate : PO43–
On utilise le réactif préparé ainsi :
- Dissoudre 5,5 g de chlorure de magnésium hexahydraté MgCl2·6H2O et 10,5 g de chlorure d'ammonium NH4Cl
 dans 100 mL d'eau.
dans 100 mL d'eau. - Au moment de l'emploi, ajouter un égal volume d'ammoniaque concentré

 à un volume de la solution précédente. Ne pas conserver ce réactif longtemps, car l'ammoniac
à un volume de la solution précédente. Ne pas conserver ce réactif longtemps, car l'ammoniac 


 s'évapore.
s'évapore.
Pour rechercher les ions phosphate :
- Dans un tube à essai, chauffer la solution à tester à 100°C, et ajouter goutte à goutte le réactif ci-dessus jusqu'à faible excès.
- En présence d'ion phosphate, il se forme un précipité dont la formule est MgNH4PO4·6H2O.
Remarques :
- La présence d'ions phosphate est incompatible avec la présence de cations du groupe VI, lesquels formeraient un précipité.
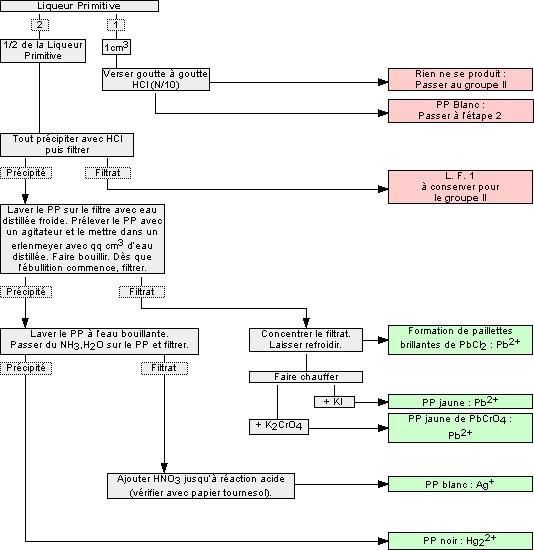
1.4 Cations du groupe I : Ag+, Hg22+, Pb2+
Ces cations forment un précipité avec l'acide chlorhydrique ![]() , insoluble dans l'eau froide.
, insoluble dans l'eau froide.
On trouve dans ce groupe les cations :
- Argent (I) Ag+
- Mercure (I) Hg22+

- Plomb (II) Pb2+

Remarques :
- Le chlorure de plomb (II) PbCl2
 est légèrement soluble dans l’eau froide, donc il en reste un peu dans LF1. Il faut donc s’attendre à la formation d'un précipité noir de sulfure de plomb (II) PbS au groupe II. Il ne faudra pas le confondre avec le sulfure de cuivre (II) CuS et le sulfure de mercure (II) HgS
est légèrement soluble dans l’eau froide, donc il en reste un peu dans LF1. Il faut donc s’attendre à la formation d'un précipité noir de sulfure de plomb (II) PbS au groupe II. Il ne faudra pas le confondre avec le sulfure de cuivre (II) CuS et le sulfure de mercure (II) HgS  .
. - Les sels de mercure (I) contiennent toujours un peu de mercure (II) que l’on retrouvera au groupe II.
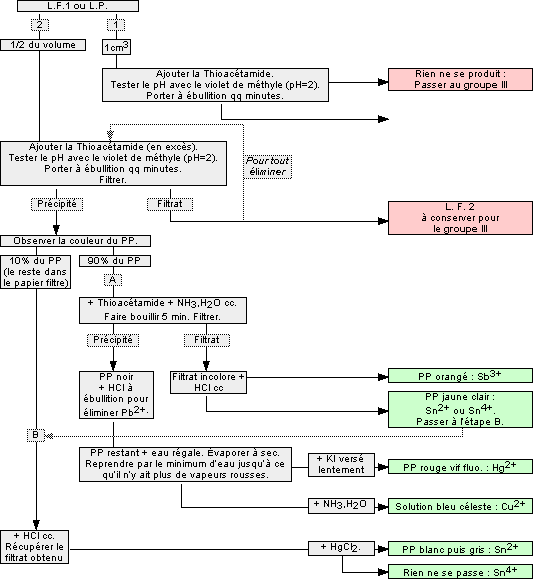
1.5 Cations du groupe II : Sn2+, Sn4+, Sb3+, Cu2+, Hg2+
Ils ne donnent pas de précipité avec l'acide chlorhydrique, mais précipitent en présence du sulfure d'hydrogène H2S ![]() pour former des sulfures insolubles en milieu acide. On distingue les deux sous-groupes :
pour former des sulfures insolubles en milieu acide. On distingue les deux sous-groupes :
- IIA : cations dont les sulfures sont insolubles dans l’eau à pH=2, et solubles dans (NH4)2Sx :
- Étain (II) Sn2+
- Étain (IV) Sn4+
- Antimoine (III) Sb3+
- Arsenic (III) As3+ (non étudié ici)
- Arsenic (V) As5+ (non étudié ici)
- IIB : cations dont les sulfures sont insolubles dans l’eau à pH=2, et insolubles dans (NH4)2Sx :
- Cuivre (II) Cu2+
- Mercure (II) Hg2+

Remarques :
- Vérifier avant d'affirmer la présence de Sn2+ que la solution décolore une goutte de permanganate de potassium


 en milieu sulfurique H2SO4 + KMnO4
en milieu sulfurique H2SO4 + KMnO4 
 .
. - Le précipité rouge vif est soluble dans un excès d'iodure de potassium KI.
- Lorsqu’on verse quelques gouttes d’eau distillée dans la LF1 ou la LP, si il se forme un précipité blanc, penser à Sb3+.
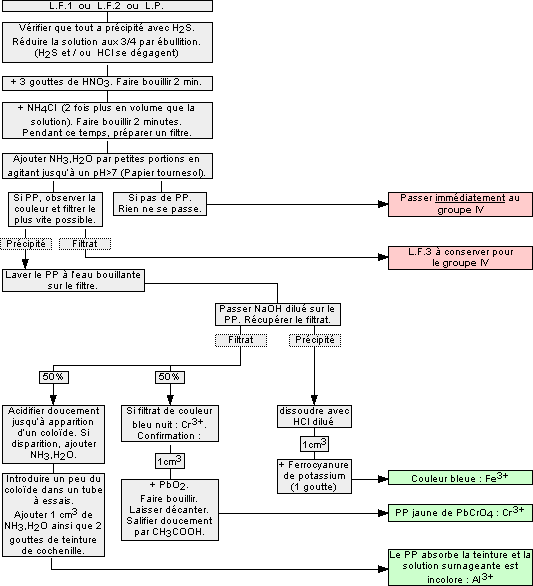
1.6 Cations du groupe III : Fe2+, Fe3+, Al3+, Cr3+
Ces cations forment des précipités avec l'hydroxyde de sodium ![]() , insolubles à pH=9-10. On trouve dans ce groupe les cations :
, insolubles à pH=9-10. On trouve dans ce groupe les cations :
- Fer (II) Fe2+
- Fer (III) Fe3+
- Aluminium (III) Al3+
- Chrome (III) Cr3+
Remarques :
- L'acide nitrique HNO3

 oxyde Fe2+ en Fe3+, car l’hydroxyde de fer (II) ne précipite pas à pH=9-10 et on trouverait le fer au groupe IV.
oxyde Fe2+ en Fe3+, car l’hydroxyde de fer (II) ne précipite pas à pH=9-10 et on trouverait le fer au groupe IV. - Il faut filtrer rapidement sinon le manganèse (groupe IV) peut donner à la longue un précipité brun, que l’on peut confondre avec le fer.
- La recherche au groupe IV doit se faire sur la LF3 ou sur (LP+NH4Cl + NH3(aq)).
- À froid, la précipitation des sels de Fe, Al, et Cr n’est pas totale.
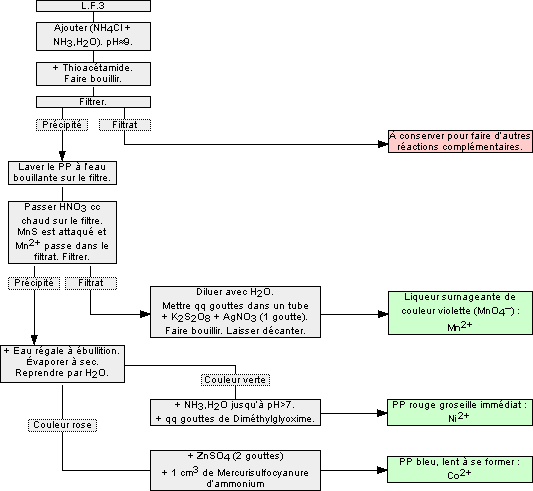
1.7 Cations du groupe IV : Mn2+, Ni2+, Co2+
Ceux dont les sulfures sont insolubles dans l’eau et les sels de NH4+ en milieu basique. On trouve dans ce groupe les cations :
- Manganèse (II) Mn+
- Nickel (II) Ni2+
- Cobalt (II) Co2+
Remarques :
- Si LF3 est incolore, il n’y a ni Ni2+ (vert en solution), ni Co2+ (rose en solution).
- Si le premier précipité contient MnS+NiS+CoS, alors il est noir. La coloration rose du sulfure de manganèse MnS peut être cachée par celles des autres.
1.8 Cations du groupe V : Ba2+, Ca2+
Ceux dont les carbonates sont insolubles dans l’eau et les sels de NH4+ : Ba2+, Ca2+
1.9 Cations du groupe VI : Mg2+
Ceux dont les phosphates sont insolubles dans l’eau : Mg2+
- L'ajout d'acide phosphorique
 doit provoquer un précipité blanc en présence de Mg2+.
doit provoquer un précipité blanc en présence de Mg2+.
Pour confirmer la présence de Mg2+ :
- L'ajout d'une solution diluée d'hydroxyde de sodium à la solution à tester provoque un précipité blanc d'hydroxyde de magnésium Mg(OH)2 qui se redissout avec un excès.
- Une fois le précipité d'hydroxyde de magnésium Mg(OH)2 obtenu, l'ajout d'une solution très diluée de fluorescéinate de sodium
 doit donner une couleur rose en bordure du précipité (et jaune ailleurs).
doit donner une couleur rose en bordure du précipité (et jaune ailleurs).
1.10 Cation potassium K+
- L'ajout de quelques gouttes d'une solution diluée d'acide picrique (2,4,6-trinitrophénol)

 forme un précipité de picrate de potassium
forme un précipité de picrate de potassium 
 en forme de cristaux en aiguille.
en forme de cristaux en aiguille. - L'ajout de quelques gouttes d'une solution de cobaltnitrite de sodium Na3Co(NO2)6 forme un précipité jaune de cobaltnitrite de potassium :
- Na3Co(NO2)6(aq) + 3 K+(aq) → K3Co(NO2)6(s) + 3 Na+(aq)
- Cette réaction est très sensible et très spécifique. On peut peser le précipité, après lavage et séchage, ou le titrer par rédox. Cependant, cette précipitation se produit aussi avec l'ion ammonium NH4+. Il faut donc éliminer les éventuels ions ammonium (s'il y en a en solution) au préalable, par ajout d'une solution d'hydroxyde de sodium
 , puis ébullition. En milieu basique, l'ammonium forme de l'ammoniac
, puis ébullition. En milieu basique, l'ammonium forme de l'ammoniac 

 , lequel s'évapore par chauffage.
, lequel s'évapore par chauffage.
1.11 Tests complémentaires
Il peut être utile de confirmer la présence d'ions avec des tests complémentaires, par exemple par formation d'un précipité avec d'autres réactifs, la couleur de la solution aqueuse, ou la couleur de la flamme.
1.11.1 Incompatibilités
Dans une solution aqueuse limpide, certains ions ne peuvent pas coexister, soit parce qu'ils pourraient réagir selon une oxydoréduction, soit parce qu'ils formeraient un précipité (solide) et donc un aspect trouble de la solution. Voici quelques exemple d'incompatibilités :
- Fe3+ (oxydant puissant) est incompatible avec un réducteur fort dans la même solution comme Sn2+ par exemple. Se reporter à la table des potentiels standards pour vérifier que les ions en présence ne sont pas supposés réagir.
- On ne peut pas avoir dans la même solution des ions chlorure Cl– et des ions Pb2+, Hg22+, Ag+ (Groupe I) car se c'était le cas on aurait un précipité (solution trouble).
1.11.2 Couleur de la solution aqueuse
Certains ions confèrent aux solutions aqueuse une coloration caractéristique. Cependant, la couleur d'un ion peut être masquée par une autre couleur ou modifiée selon le pH : il faut se méfier des conclusions hâtives.
| Ion | Couleur en solution aqueuse |
|---|---|
| Cu2+ | Bleu clair à foncé (ou vert si présence de Cl–, mais pas obligatoirement) |
| Cr3+ | Bleu-vert pâle à foncé (selon concentration) |
| Ni2+ | Vert pâle à vert vif (selon concentration) |
| Co2+ | Rose pâle à foncé (ou bleu si présence de Cl–) |
| Fe2+ | Vert très pâle ou incolore |
1.11.3 Couleur de flamme
Voir : Flammes colorées
1.11.4 Précipités avec les cations
| Ion | Eau oxygénée H2O2 |
Hydroxyde de sodium NaOH |
Chlorure de baryum BaCl2 |
Iodure de potassium KI |
|---|---|---|---|---|
| Fer (II), Fe2+ | Précipité brun/foncé Fe2O3 | Précipité vert Fe(OH)2 | ||
| Fer (III), Fe3+ | Bulles de dioxygène | Précipité rouille Fe(OH)3 | Précipité brun clair et tétrachlorométhane CCl4 | |
| Cuivre (II), Cu2+ | Précipité bleu clair Cu(OH)2 | Précipité brun clair et tétrachlorométhane CCl4 | ||
| Zinc (II), Zn2+ | Précipité blanc Zn(OH)2 | |||
| Aluminium (III), Al3+ | Précipité blanc gélatineux Al(OH)3 | |||
| Argent, Ag+ | Précipité blanc AgOH | Précipité blanc AgCl (noircit à la lumière) | Précipité jaune très pâle AgI | |
| Plomb, Pb2+ | Précipité blanc PbCl2 | Précipité jaune vif PbI2 | ||
| Mercure (I), Hg22+ | Précipité blanc Hg2Cl2 | Précipité vert olive Hg2I2 | ||
| Mercure (II), Hg2+ | Précipité rouge vermillon HgI2 soluble dans un excès de KI | |||
| Magnésium (II), Mg2+ | Précipité blanc qui se redissout dans un excès de NaOH. |
Remarque :
- Le caractère oxydant de la solution est montré par l'action de l'iodure de potassium KI en milieu sulfurique dilué. S’il y a formation de diiode

 caractérisée par une coloration jaune ou brune, soluble dans le tétrachlorométhane CCl4
caractérisée par une coloration jaune ou brune, soluble dans le tétrachlorométhane CCl4 
 (ou si en chauffant il se crée des vapeurs violettes), alors la solution contient au moins un ion à caractère oxydant : penser à Fe3+ et Cu2+.
(ou si en chauffant il se crée des vapeurs violettes), alors la solution contient au moins un ion à caractère oxydant : penser à Fe3+ et Cu2+.
1.11.5 Précipités avec les anions
| Ion | Nitrate d'argent AgNO3 |
Chlorure de baryum BaCl2 |
|---|---|---|
| Sulfate, SO42– | Précipité blanc BaSO4 lourd qui persiste à ébullition | |
| Chlorure, Cl– | Précipité blanc AgCl (noircit à la lumière) | |
| Bromure, Br– | Précipité jaunâtre AgBr (noircit à la lumière) |
1.11.6 Autres
- Tremper l’extrémité d’un bout de cuivre dans la solution. Si celui-ci devient argenté et si en approchant cet argenté près d’une flamme celui-ci s’évapore, la solution contient des ions mercure
 Ne pas respirer les vapeurs !
Ne pas respirer les vapeurs ! - Addition d'acide sulfurique dilué
 : si précipité blanc, penser à Pb2+ et Ba2+.
: si précipité blanc, penser à Pb2+ et Ba2+. - Addition d'acide sulfurique concentré
 : si précipité blanc, penser à Pb2+, Ba2+ et Ca2+.
: si précipité blanc, penser à Pb2+, Ba2+ et Ca2+. - Caractère réducteur de la solution :
- Décoloration du permanganate de potassium


 en milieu sulfurique dilué : penser à Sn2+, Fe2+, Br–, Cr3+ (à chaud).
en milieu sulfurique dilué : penser à Sn2+, Fe2+, Br–, Cr3+ (à chaud). - Décoloration du permanganate de potassium


 en milieu sulfurique concentré
en milieu sulfurique concentré  : penser aux précédents et à Cl–.
: penser aux précédents et à Cl–.
- Décoloration du permanganate de potassium
- La thioacétamide

 chauffée en présence d'eau donne du sulfure d'hydrogène H2S(g)
chauffée en présence d'eau donne du sulfure d'hydrogène H2S(g)  .
. - Le sulfure d'hydrogène H2S(g)
 en présence d'ammoniaque
en présence d'ammoniaque 
 forme du sulfure d'ammonium, puis une polysulfure d'ammonium :
forme du sulfure d'ammonium, puis une polysulfure d'ammonium :
- H2S(g) + 2 NH3(aq) → S(NH4)2(aq)
- S(NH4)2 → Sx(NH4)2 (réaction lente)
- Voir aussi : http://pedagogie.ac-toulouse.fr/svt/serveur/labo/recette/mineraux.html
- Le "Vogel"[1] est un livre de référence du chimiste dans lequel on trouvera de nombreux tests d'identification d'éléments, aussi bien en chimie minérale qu'organique.
2 Réactifs pour analyse
- Une liste de réactifs avec leur préparation : http://pagesperso-orange.fr/ptl/Repertoire/repertoire.html
- Voir aussi : Catégorie:Analyse
3 Références
- Aller ↑ Practical organic chemistry, including qualitative organic analysis, Arthur I. Vogel, 3e édition, éd. Longman. ISBN 0-582-44245-1