Acide phosphorique
Un article du site scienceamusante.net.
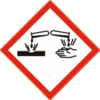
|
| GHS05 |
- Formule : H3PO4
- Autres dénominations : acide orthophosphorique, E338
- Ne pas confondre avec : acide métaphosphorique HPO3, acide phosphoreux H3PO3
- N°CAS : 7664-38-2
- N°CE : 231-633-2
Sommaire
[masquer]1 Propriétés physiques
- Masse molaire : 97,995 g/mol
- Température de fusion : 42,35°C
- Température d'ébullition : 213°C (décomposition)
- Masse volumique : 1,834 g/mL à 18°C (pur)
L'acide phosphorique est un triacide, dont la première acidité est très forte. Les ions H2PO4– (dihydrogénophosphate) et HPO42– (hydrogénophosphate) sont des ampholytes (couples : H2PO4–/HPO42– et HPO42–/PO43–). On considère généralement (selon la théorie de Brønsted) l'acide phosphorique comme un triacide fort, totalement dissocié dans l'eau. Il est d'importance capitale en biochimie.
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
3 C ≥ 25%
- Corrosion cutanée/irritation cutanée, catégorie 1B
![]() Danger
Danger
- H314 : Provoque de graves brûlures de la peau et de graves lésions des yeux.
4 10 % ≤ C < 25%
- Corrosion cutanée/irritation cutanée, catégorie 2
- Lésions oculaires graves/irritation oculaire, catégorie 2
![]() Attention
Attention
5 Commentaires
- Comme l'indique son point de fusion, l'acide phosphorique est solide à température ambiante, on le trouve cependant plutôt rarement sous forme solide dans sa présentation commerciale, mais plus souvent sous forme de solution aqueuse à 70% massique ou 85% massique.
6 Où s'en procurer ?
- Auprès des vendeurs de matériel et produits spécialisés.
- Drogueries et magasins de bricolage, supermarchés : dégrippant, dérouillant, concentré à 70%.
7 Références
- Wikipédia : http://fr.wikipedia.org/wiki/Acide_phosphorique