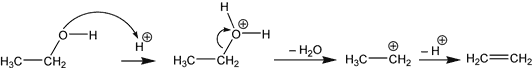Éther éthylique/synthèse
Un article du site scienceamusante.net.
Cette réaction peut avoir un intérêt pour préparer en laboratoire un éther (solvant aprotique polaire).
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- L'éthanol et l'éther éthylique sont des solvants très inflammables
 et dont les vapeurs sont nocives
et dont les vapeurs sont nocives  . Travailler dans une zone ventilée et sans source de chaleur ou flamme directe.
. Travailler dans une zone ventilée et sans source de chaleur ou flamme directe. - L'acide sulfurique
 concentré présente un danger à manipuler. Porter obligatoirement des gants adaptés et des lunettes de protection.
concentré présente un danger à manipuler. Porter obligatoirement des gants adaptés et des lunettes de protection. - La distillation des éthers peut conduire à la concentration de peroxydes qui sont explosifs
 ! Ne jamais distiller un éther à sec ! Toujours vérifier la présence de peroxydes.
! Ne jamais distiller un éther à sec ! Toujours vérifier la présence de peroxydes.
2 Matériel et produits
- Éthanol absolu

- Acide sulfurique très concentré

- Chauffe-ballon
- Ballon bicol rodé
- Ampoule de coulée (non isobare)
- Colonne à distiller
- Réfrigérant droit
- Ballon collecteur
3 Protocole
- Réaliser un montage de distillation classique. Le ballon bicol supporte la colonne à distiller et l'ampoule de coulée.
- Dans le ballon bicol, ajouter 25 mL d'éthanol. Si l'éthanol utilisé est dénaturé, comme l'alcool de pharmacie à 70° ou 90° (dénaturé au camphre) ou de l'alcool à brûler (alcool ménager, dénaturé au méthanol et autres produits), le distiller pour éliminer au maximum les dénaturants. Il sera impossible d'obtenir de l'éthanol absolu par cette méthode en raison d'un azéotrope avec le méthanol


 et l'eau.
et l'eau. - Dans l'ampoule de coulée, placer 10 mL d'acide sulfurique très concentré
 . L'ajouter goutte à goutte.
. L'ajouter goutte à goutte. - Chauffer le mélange sous vive agitation jusqu'au reflux.
- Les premières vapeurs arrivant en tête de colonne doivent être à la température de 36 °C, ce qui correspond à la température d'ébullition de l'éther éthylique. Si cette température dépasse les 40 °C, il faut arrêter le chauffage et laisser refroidir, sinon on risquerait de distiller également l'éthanol n'ayant pas réagi.
- On récupère ainsi plusieurs mL d'éther éthylique

 . Si l'alcool de départ était dénaturé au méthanol, l'éther obtenu contiendra un peu de méthoxyéthane CH3-O-CH2-CH3 et sans doute aussi du méthoxyméthane CH3-O-CH3.
. Si l'alcool de départ était dénaturé au méthanol, l'éther obtenu contiendra un peu de méthoxyéthane CH3-O-CH2-CH3 et sans doute aussi du méthoxyméthane CH3-O-CH3.
4 Théorie
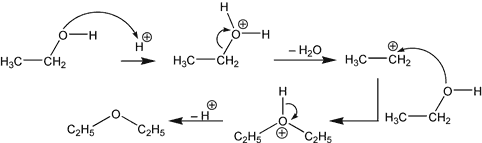
Cette manipulation est une réaction de déshydratation intermoléculaire, elle est obtenue par chauffage d'un alcool en présence d'un acide protonique. Suivant le domaine de température, il y a 2 réactions qui sont en compétition, la déshydratation intermoléculaire, et la déshydratation intramoléculaire.
- La déshydratation intramoléculaire conduit à un alcène (ou à un mélange d'alcènes) avec départ d'eau, et se produit a des températures assez "basses", de l'ordre de 50-120 °C suivant les alcools employés. Dans le cas de l'éthanol, l'alcène produit est l'éthylène

 :
:
- La déshydratation intermoléculaire produit un étheroxyde R-O-R (si on utilise un seul alcool, ou alors R-O-R', si on utilise un mélange d'alcools), avec départ d'eau. Elle se produit à des températures avoisinant les 140 °C. Dans le cas de la synthèse de l'éther éthylique, la température idéale est de 145 °C. (Cela dit, la température du mélange réactionnel est limitée par la température d'ébullition du mélange éthanol + acide sulfurique, qui avoisine 70-80 °C.)
- Les alcools primaires (R-CH2OH) conduisent à des alcènes ou à des étheroxydes.
- Les alcools secondaires (RR'CH-OH) conduisent eux aussi à des alcènes (parfois dissymétriques) et des étheroxydes symétriques.
- Les alcools tertiaires (RR'R"C-OH) ne produisent pas d'alcènes et se déshydratent en étheroxydes avec des conditions plus drastiques.
- Un acide protonique est un acide minéral pur capable de libérer des protons (classiquement : l'acide sulfurique H2SO4
 , l'acide phosphorique H3PO4
, l'acide phosphorique H3PO4  ), on n'emploie jamais d'acide nitrique
), on n'emploie jamais d'acide nitrique 
 , à cause de son action oxydante et des réactions parasites avec l'ion nitrate et du fait qu'il soit généralement en solution aqueuse, ni l'acide chlorhydrique
, à cause de son action oxydante et des réactions parasites avec l'ion nitrate et du fait qu'il soit généralement en solution aqueuse, ni l'acide chlorhydrique  pour cette même raison.
pour cette même raison.
- Note : ici, R est une chaîne carbonée classique, R' est une autre chaîne carbonée classique, mais différente de R, et enfin R" est encore une autre chaîne carbonée classique, différente de R et R'.
5 Remarques
- La synthèse de l'éther éthylique peut aussi se faire par hydratation de l'éthylène

 . Mais cette méthode demande à fabriquer et à manipuler l'éthylène, gaz très inflammable, ce qui est beaucoup moins aisé.
. Mais cette méthode demande à fabriquer et à manipuler l'éthylène, gaz très inflammable, ce qui est beaucoup moins aisé. - L'éther éthylique doit être conservé à l'abri de la chaleur et du soleil, en raison de sa très forte volatilité et sa température d'ébullition proche de la température ambiante, de préférence dans une armoire ventilée.
- Il ne doit pas être conservé au contact de l'air, car il se forme des peroxydes instables. Voir : Détecter et éliminer les peroxydes dans l'éther.