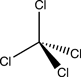
Tétrachlorométhane
Un article du site scienceamusante.net.
(Redirigé depuis Tétrachlorure de carbone)

|
| GHS06 |

|
| GHS08 |

|
| GHS07 |
- Formule brute : CCl4
- Autre dénomination : tétrachlorure de carbone, perchlorure de carbone, perchlorométhane
- N°CAS : 56-23-5
- N°CE : 200-262-8
Sommaire
[masquer]1 Propriétés physiques [1]
- Masse molaire : 153,82 g/mol
- Température de fusion : –23°C
- Température d'ébullition : 76,8°C
- Densité du liquide : 1,594 (par rapport à l'eau)
- Densité de vapeur : 5,3 (par rapport à l'air)
- Non miscible avec l'eau.
- Aspect : liquide incolore, volatil, odeur éthérée.
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
- Cancérogénicité, catégorie 2
- Toxicité aiguë par voie orale, catégorie 3
- Toxicité aiguë par voie cutanée, catégorie 3
- Toxicité aiguë par inhalation, catégorie 3
- Toxicité spécifique pour certains organes cibles - Exposition répétée, catégorie 1
- Danger pour le milieu aquatique, toxicité à long terme (chronique), catégorie 3
- Dangereux pour la couche d'ozone, catégorie 1
![]()
![]()
![]() Danger
Danger
- H351 : Susceptible de provoquer le cancer.
- H301+H311+H331 : Toxique par ingestion, par contact cutané ou par inhalation.
- H372 : Risque avéré d’effets graves pour les organes à la suite d’expositions répétées ou d’une exposition prolongée.
- H412 : Nocif pour les organismes aquatiques, entraîne des effets néfastes à long terme.
- H420 : Nuit à la santé publique et à l’environnement en détruisant l’ozone dans la haute atmosphère.
| Voir / adapter / imprimer cette étiquette |
3 Usages
- Le tétrachlorure de carbone est un solvant utilisé en chimie organique, notamment pour des réactions radicalaires, de polymérisation... Cependant son usage tend à diminuer en raison de sa forte toxicité et de sa nuisance pour la couche d'ozone.
- On lui préfère comme solvants de remplacement le chloroforme (trichlorométhane)

 ou le dichlorométhane
ou le dichlorométhane  (qui sont tout de même dangereux).
(qui sont tout de même dangereux). - Il fait partie de la famille des halogénoalcanes (chlorométhane, dichlorométhane, trichlorométhane et tétrachlorométhane) obtenus par la chloration directe du méthane (réaction industrielle, ce sont des solvants de base de l'industrie chimique).
4 Où s'en procurer ?
- Auprès des vendeurs de matériel et produits spécialisés.