Synthèse d'un ester par micro-ondes
Dans une autre expérience, nous avons vu comment réaliser des estérifications pour fabriquer des odeurs fruités. Mais la réaction d'estérification classique n'est pas totale et demande que l'on chauffe les réactifs.
Les micro-ondes (à l'aide d'un four micro-onde classique) sont de plus en plus utilisés en chimie car ils permettent de réaliser des réactions parfois bien plus rapidement (quelques minutes) et avec des rendements excellents (entre 90 et 100%). La présente expérience illustre l'utilisation des micro-ondes comme activateurs de réactions chimiques. Cette expérience fait partie de la catégorie chimie verte, car elle utilise une méthode d'activation peu coûteuse en énergie.
Sommaire
[masquer]1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Manipuler les acides avec grande précautions, surtout l'acide sulfurique
 . Attention à l'endroit où vous poser les pipettes qui ont été utilisées, les acides sont corrosifs, certains dégagent de très fortes odeurs.
. Attention à l'endroit où vous poser les pipettes qui ont été utilisées, les acides sont corrosifs, certains dégagent de très fortes odeurs. - Les alcools sont des produits nocifs et hautement inflammables
 . Rebouchez soigneusement les flacons et éloignez-les de toutes sources de chaleur, flamme ou lumière.
. Rebouchez soigneusement les flacons et éloignez-les de toutes sources de chaleur, flamme ou lumière. - Les esters obtenus sont totalement impropres à la consommation, ne pas les goûter et ne pas se les mettre sur la peau ! Les esters sont généralement des produits inflammables et irritants

 .
. - Utiliser un four micro-onde de cuisine pour réaliser des réactions chimique doit se faire en respectants les consignes détaillées ci-dessous.
2 Précautions particulières d'utilisation d'un four micro-onde pour la chimie
Respectez les consignes suivantes pour réduire les risques :
- Utiliser des récipients supportant les fortes variations de température : Pyrex® par exemple. Ne pas utiliser de plastique pouvant fondre ou être attaqués par les réactifs et produits.
- Si les produits sont toxiques ou nocifs


 , ne pas utiliser un four micro-onde qui est aussi utilisé pour faire la cuisine ; utiliser un four qui ne servira qu'à la chimie.
, ne pas utiliser un four micro-onde qui est aussi utilisé pour faire la cuisine ; utiliser un four qui ne servira qu'à la chimie. - Certaines substances étant fortement chauffées par l'action des micro-ondes, il peut y avoir une forte ébullition et dégagement de vapeurs dans le four. Si ces vapeurs sont inflammables
 , un risque d'inflammation spontanée ou d'explosion est toujours probable. Placer le four sur une table dégagée et ne pas rester devant la porte du four. Prévoir un extincteur adapté à proximité.
, un risque d'inflammation spontanée ou d'explosion est toujours probable. Placer le four sur une table dégagée et ne pas rester devant la porte du four. Prévoir un extincteur adapté à proximité. - Il est préférable de chauffer par tranches de 30 secondes en contrôlant à chaque fois le contenu du four.
- Les récipients pouvant être brûlants après chauffage, se munir de pinces et gants adaptés à la chaleur pour sortir les récipients du four.
- Après chaque utilisation, nettoyer le four. Cela évite un encrassement irréversible.
3 Matériel
- Erlenmeyer de 50 ou 100 mL
- Pince en bois
- Pipettes jetables en plastique, pipettes Pasteur ou compte-gouttes
- Acide éthanoïque (acétique)

- Alcool isoamylique (3-méthylbutan-1-ol)


- Acide sulfurique concentré H2SO4

- Four à micro-ondes
4 Protocole expérimental
- Dans l'erlenmeyer, placer des quantités stœchiométriques de l'acide acétique
 et d'alcool isoamylique
et d'alcool isoamylique 
 , sans toutefois en mettre plus que le dixième de volume de l'erlenmeyer. Ajouter une goutte d'acide sulfurique concentré
, sans toutefois en mettre plus que le dixième de volume de l'erlenmeyer. Ajouter une goutte d'acide sulfurique concentré  .
. - Placer l'erlenmeyer dans le four micro-onde, sans que celui-ci soit au centre du plateau tournant : placer le récipient vers le bord du plateau tournant de sorte que le récipient soit un peu agité pendant le chauffage et ne reste pas toujours au même endroit du four.
- Sur la position de puissance maximale (généralement 800 ou 900 W), allumer le four pendant 30 secondes. Vérifier de manière visuelle que l'ébullition ne fasse pas déborder le mélange du récipient. Une forte odeur de banane devrait se dégager.
- Poursuivre la réaction par tranches de 10 secondes d'irradiation aux micro-ondes, jusqu'à ce que le mélange prenne une teinte très légèrement rosée. Ne pas poursuivre au-delà car le mélange pourrait virer au noir.
- Sortir le récipient avec la pince ou des gants adaptés et le laisser refroidir. Ne pas respirer directement les vapeurs chaudes et irritantes en sortie du récipient !
- Après refroidissement, il est possible de sentir l'odeur de banane dans toute la pièce !
Le mélange obtenu contient encore de l'acide sulfurique ![]() , il n'est pas propre à la consommation !
, il n'est pas propre à la consommation !
- Ensuite, il est possible de purifier ou d'analyser le mélange obtenu avec les techniques classiques de chimie (extraction liquide-liquide, chromatographie, etc.).
5 Explications
- Une réaction d'estérification peut avoir lieu lorsqu'un acide et un alcool sont présents dans un milieu acide (l'acide sulfurique sert de catalyseur).
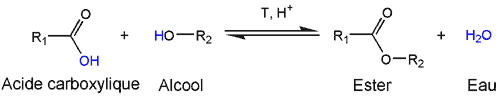
- En utilisant les micro-ondes, on chauffe uniquement le mélange réactionnel, et le récipient, avec un minimum de perte d'énergie par ailleurs. Les micro-ondes du four sont des ondes électromagnétiques dont la fréquence est spécialement ajustée pour chauffer au maximum les molécules d'eau. Les molécules d'eau produites dans l'estérification s'évaporent, ce qui contribue à déplacer l'équilibre chimique vers la droite. La réaction est ainsi totale.
- Si le temps d'irradiation est trop important, les molécules d'ester peuvent se dégrader à leur tour en formant des composés divers, d'où une apparition de couleur rose voire noire dans le pire des cas. Il est important de bien contrôler la réaction afin que cela n'arrive pas, si l'on veut obtenir un bon rendement en ester. Il est difficile de prévoir à l'avance quel sera le temps optimal car les produits peuvent contenir des impuretés provoquant des réactions parallèles, et que les fours à micro-ondes peuvent varier en qualité.
6 Voir aussi
7 Références
- Pour en savoir plus sur le concept de "chimie verte", voir l'ouvrage : Quelles sont les ressources de la chimie verte ?, Stéphane Sarrade ; EDP Sciences (2008), ISBN 978-2-86883-989-3
