Utilisateur:Alexchimiste/travaux

| |
| Cette page fait partie des articles en travaux !
Tant qu'elle n'est pas terminée, il est déconseillé de la lire. |
|
| Un utilisateur est chargé de rédiger cette page. Merci de ne pas éditer cette page pour ne pas perturber son travail. |
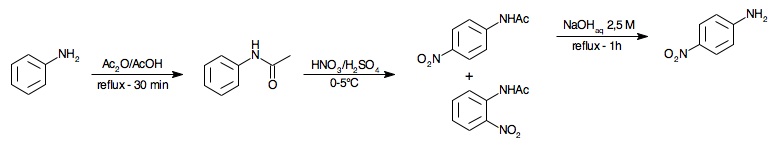
1 Synthèse de la 4-nitroaniline
Il s'agit ici de synthétiser la 4-nitroaniline ![]()
![]() en trois étapes à partir de l'aniline
en trois étapes à partir de l'aniline ![]()
![]()
![]()
![]() . Cette substance sert de précurseur à la synthèse du rouge para, qui est un fort colorant organique, le premier à avoir été synthétisé par diazotation.
. Cette substance sert de précurseur à la synthèse du rouge para, qui est un fort colorant organique, le premier à avoir été synthétisé par diazotation.
1.1 Principe de la synthèse
La 4-nitroaniline s'obtient par nitration de l'aniline ![]()
![]()
![]()
![]() , après protection de sa fonction amine.
, après protection de sa fonction amine.
La nitration est une réaction de substitution électrophile [1], catalysée par un acide protonique (fort), ici l'acide sulfurique, et conduite sur un cycle aromatique, ici l'aniline. Cette réaction met en jeu l'ion nitronium NO2+ qui est l'espèce électrophile.
En pratique, il est impossible d'effectuer une nitration directe de l'aniline car, en dehors du fait que verser de l'acide nitrique concentré sur de l'aniline provoque une réaction explosive certaine[2] ![]() , l'aniline est une base qui capte un proton pour former l'ion anilinium C6H5NH3+. Ceci oriente la substitution électrophile en position 3 du groupement -NH2 déjà en place sur le cycle, ce qui n'est pas la réaction souhaitée.
, l'aniline est une base qui capte un proton pour former l'ion anilinium C6H5NH3+. Ceci oriente la substitution électrophile en position 3 du groupement -NH2 déjà en place sur le cycle, ce qui n'est pas la réaction souhaitée.
Pour éviter d'obtenir la 3-nitroaniline, mais bien préparer la 4-nitroaniline, nous allons procéder en trois étapes :
- Protection de la fonction amine -NH2 par de l'anhydride acétique : nous obtiendrons alors de l'acétanilide (ou N-phényléthanamide), ce qui permettra d'éviter l'oxydation de la fonction amine par l'acide nitrique dans l'étape suivante.
- Nitration de l'acétanilide en utilisant un mélange d'acide nitrique et d'acide sulfurique, tout deux concentrés : on obtiendra alors un mélange de 2-nitroacétanilide et de 4-nitroacétanilide. L'isomère 2- étant peu abondant à cause de l'encombrement stérique autour de l'amide, on s'efforcera de l'éliminer par recristallisation.
- Déprotection de la 4-nitroacétanilide par hydrolyse en milieu basique (NaOH) de la fonction amide, qui conduit à la 4-nitroaniline

 .
.
1.2 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- L'aniline



 , la 4-nitroacétanilide
, la 4-nitroacétanilide  , la 2-nitroacétanilide
, la 2-nitroacétanilide  et la 4-nitroaniline
et la 4-nitroaniline 
 sont tous quatre des produits toxiques (voire cancérogènes), il convient de les manipuler en étant muni de gants, et travailler sous hotte aspirante.
sont tous quatre des produits toxiques (voire cancérogènes), il convient de les manipuler en étant muni de gants, et travailler sous hotte aspirante. - L'acide sulfurique
 , l'acide nitrique
, l'acide nitrique 
 , l'anhydride acétique
, l'anhydride acétique 

 et l'acide éthanoïque
et l'acide éthanoïque  sont quatre substances concentrées, très corrosives et qui émettent des vapeurs irritantes. Il convient de les manipuler sous hotte aspirante, en étant muni de gants épais et de lunettes protectrices.
sont quatre substances concentrées, très corrosives et qui émettent des vapeurs irritantes. Il convient de les manipuler sous hotte aspirante, en étant muni de gants épais et de lunettes protectrices. - L'acide chlorhydrique
 et l'hydroxyde de sodium
et l'hydroxyde de sodium  sont en solution diluée, mais restent corrosifs.
sont en solution diluée, mais restent corrosifs.
1.3 Matériel nécessaire
Le matériel classique de laboratoire est nécessaire, à savoir : balance, spatules, baguettes en verre pour l'agitation, barreaux aimantés pour l'agitation magnétique, papier filtre, boîtes de Petri ou cristallisoirs pour recueillir les solides, trompe à eau (ou mieux, pompe à vide), papier pH, banc Kofler, étuve ou four...
Le détail du matériel utilisé dans chacune des étapes n'est pas réalisé car on utilise plusieurs fois les mêmes pièces de verrerie ; il suffit juste de les nettoyer durant les périodes de relâchement.
- Ballon tricol de 250 mL
- Réfrigérant de reflux
- Ampoule de coulée non isobare
- Barreau aimanté ovoïde
- Éprouvettes graduées de 25 mL, 50 mL et 100 mL
- Entonnoir en verre
- Bécher de 250 mL et 400 mL
- Ballon monocol (100 mL) pour la recristallisation
- Entonnoir Büchner
- Fiole à filtrer
- Agitateur magnétique chauffant ou chauffe ballon à agitation magnétique
- Bain de glace
1.4 Synthèse de l'acétanilide
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Aniline | C6H7N | 93,1 | 99% | –6,3 | 184 | 1,021 | |||||
| Acide acétique | C2H4O2 | 60,05 | 99,5% | 16 | 118 | 1,049 | |||||
| Anhydride acétique | C4H6O3 | 102,09 | 99,5% | –73,1 | 140 | 1,087 | |||||
| Zinc en poudre | Zn | 65,41 | - | - | - | - |
- Dans un ballon tricol de 250 mL équipé d'un réfrigérant de reflux, d'une ampoule de coulée et d'un barreau aimanté, verser 25 mL (0,271 mol) d'aniline, suivis par 40 mL d'acide éthanoïque glacial et 0,5 g de zinc en poudre (sert à réduire les impuretés colorées).
- Couler goutte à goutte, par l'intermédiaire de l'ampoule de coulée, 35 mL (0,371 mol) d'anhydride acétique en agitant.
- Chauffer doucement à reflux pendant 30 minutes.
- Refroidir le milieu réactionnel jusqu'à la température ambiante.
- Filtrer le milieu réactionnel sur un filtre plissé sur un entonnoir en verre, le filtrat est recueilli dans un bécher contenant 150 mL d'eau et 50g de glace. Le contenu du bécher est agité avec un agitateur magnétique continuellement au fur et à mesure de la filtration (cette étape correspond à l'hydrolyse du milieu réactionnel).
- Refroidir le contenu du bécher avec un bain de glace jusque 0°C.
- Filtrer le contenu du bécher sous vide avec un entonnoir de Büchner, laver le gâteau solide avec un peu d'eau glacée jusqu'à quasi neutralité du filtrat, et essorer le solide en tirant sous vide.
1.5 Synthèse de la 4-nitroacétanilide
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|---|---|---|---|---|---|---|
| Acétanilide | C8H9NO | 135,17 | substrat | 114 | 340 | - | |
| Acide éthanoïque | C2H4O2 | 60,05 | 99,5% | 16 | 118 | 1,049 | |
| Acide sulfurique | H2SO4 | 98,08 | 96% | - | - | 1,84 | |
| Acide nitrique | HNO3 | 63,01 | 65-68% | - | - | 1,41 | |
| Hydrogénocarbonate de sodium | NaHCO3 | 86,01 | 10% mas. dans l'eau | - | - | - | |
| Éthanol | C2H6O | 46,07 | 95% | - | 79 | 0,79 |
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|
- Dans un ballon tricol de 250 mL équipé d'un thermomètre, d'une ampoule de coulée, et d'un barreau aimanté, introduire 30g (0,222 mol) d'acétanilide. Agiter le solide avec l'agitation magnétique, et verser lentement 30 mL d'acide éthanoïque glacial de manière à dissoudre tout l'acétanilide dans l'acide éthanoïque.
- Une fois la dissolution réalisée verser goutte à goutte, avec précautions, en agitant vigoureusement et en refroidissant le contenu du tricol avec un bain glace/sel, 50 mL d'acide sulfurique concentré, on doit ainsi obtenir une solution limpide.
- A partir de ce moment, il est impératif de refroidir le contenu du tricol avec un bain de glace/sel, la température du milieu réactionnel ne doit pas dépasser 10°C, il peut y avoir un risque de polysubstitutions dans le cas contraire, ce qui pourrait conduire à une explosion
 .
. - Refroidir le milieu réactionnel aux environs de 0°C-5°C (si vous réussissez à aller en dessous de 0°C, c'est tant mieux), verser prudemment et goutte à goutte 30 mL (0,228 mol en acide nitrique) d'un mélange sulfonitrique à 50/50, en agitant le milieu réactionnel durant l'addition.
- Après addition de la totalité du mélange sulfonitrique, laisser la réaction se produire en agitant le milieu réactionnel pendant 30 minutes et en retirant le tricol du bain réfrigérant. La température doit rester inférieure à 30°C.
- Verser le milieu réactionnel dans un bécher de 600 mL agité magnétiquement contenant 150 mL d'eau et 50g de glace. Si nécessaire, ajouter de la glace. Un solide jaune/blanc précipite. Laisser reposer durant 15 minutes.
- Filtrer sous vide le contenu du bécher, sur Büchner ou entonnoir fritté. Laver le produit brut à l'eau, en le malaxant. Reprendre le solide sur l'entonnoir, le verser dans un grand bécher ( 1 L minimum), et verser dedans doucement et par petites portions, 200 mL d'une solution à 10% massique de bicarbonate de sodium (attention à la formation de mousse), bien agiter !
- Filtrer de nouveau le contenu du bécher sur le Büchner, contrôler le pH du filtrat, s'il est encore acide, laver de nouveau le solide avec un peu de la solution de bicarbonate de sodium, jusqu'à neutralité.
- Une fois le filtrat neutre, laver le solide avec un minimum d'eau glacée.
- A partir de cet instant, le solide est gorgé d'eau... Le seul moyen d'en obtenir une forme exploitable est d'essorer ce produit sur le Büchner, de bien tirer sous vide. Ensuite, le solide est pressé manuellement entre des feuilles de papier filtre (4 ou 5 feuilles de format A3 seront nécessaires)....
- Le produit brut est recristallisé (plusieurs fois éventuellement) dans de l'éthanol. Le filtrat de la recristallisation contient de la 2-nitroacétanilide, et le solide est majoritairement de la 4-nitroacétanilide

 .
.
1.6 Synthèse de la 4-nitroaniline
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|---|---|---|---|---|---|---|
| 4-nitroacétanilide | C8H8N2O3 | 180,16 | substrat | 215 | - | - | |
| Hydroxyde de sodium | NaOH | 40 | 10% mas. dans l'eau | - | - | - | |
| Acide chlorhydrique | HCl | 36,46 | 10% mas. dans l'eau | - | - | - | |
| Éthanol | C2H6O | 46,07 | 95% | - | 79 | 0,79 |
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|
- Dans un ballon tricol de 250 mL équipé d'un réfrigérant de reflux, d'une ampoule de coulée et d'un barreau aimanté, introduire 18 g (0,010 mol) de 4-nitroacétanilide et 40 mL (0,1 mol) d'une solution à 10% massique en hydroxyde de sodium. Agiter et porter à reflux pendant une heure.
- Refroidir le milieu réactionnel jusqu'à la température ambiante.
- Verser le contenu du tricol dans un bécher, et verser une solution à 10% d'acide chlorhydrique en contrôlant le pH. Ne pas dépasser pH = 7, sinon on obtient la forme protonnée de la 4-nitroaniline : l'ion 4-nitroanilinium, soluble dans l'eau.
- Refroidir à nouveau le mélange dans un bain de glace/sel jusqu'à 0°C et filtrer sur Büchner.
- Laver ensuite plusieurs fois le solide avec de l'eau. Sécher dans une étuve à 80°C.
- Recristalliser le solide obtenu dans un mélange d'eau et d'éthanol, pour ce faire :
- réaliser la dissolution du solide dans un minimum d'éthanol à ébullition,
- verser une quantité d'eau juste nécessaire à la re-précipitation du solide,
- rajouter la quantité d'éthanol juste nécessaire à la re-dissolution du solide,
- cesser le chauffage,
- verser la solution obtenue encore chaude dans un bécher propre, et laisser la cristallisation opérer lentement.
On obtient de magnifiques cristaux jaunes, que l'on sèche dans une étuve à 80°C. Masse attendue de produit purifié : 13,79 g.
1.7 Commentaires
- Le contrôle de la qualité des produits obtenus au fur et à mesure des étapes peut être réalisé par chromatographie sur couche mince, en utilisant des références des produits synthétisés.
- Les filtrats des deux premières étapes doivent être jetés dans un bidon de récupération des acides organiques. Les filtrats de la dernière étape doivent être vidés dans un bidon de récupération des déchets basiques.
- La différence entre les points de fusion des deux isomères la paranitro forme des liaisons hydrogènes intermoléculaires, ce qui justifie sa température de fusion très élevée >200°C
alors que pour l'orthonitro la liaison H est intramoléculaire, du coup les atomes d'oxygene et d'hydrogène concernés ne sont plus autant disponibles pour les liaisons H intermoléculaires et les molécules sont donc moins liées entre elles que l'isomere para, ce qui justifie une chute énorme du Tfus.
1.8 Références
- ↑ Un électrophile est une espèce chimique qui aime les électrons, il s'agit d'un intermédiaire réactionnel chargé positivement.
- ↑ Réactions chimiques dangereuses, INRS, ISBN 2-85599-778-X
- Manipulations issues de sujets de travaux pratiques du baccalauréat STL chimie, testées en laboratoire par Alexchimiste. Les rendements ne sont pas indiqués, mais ils sont suffisamment importants pour être reproductibles en laboratoire (l'acétanilide : environ 95%, la 4-nitroacétanilide : environ 70%, et la 4-nitroaniline : environ 75%).
- Contribution à cette page : Sachemist pour l'ébauche, Alexchimiste pour la rédaction, Milamber pour les schémas de montages.
2 Synthèse du Pourpre de Tyr
Le Pourpre de Tyr, ou Pourpre impérial, est un colorant organique qui était employé dans l'Antiquité pour teindre les vêtements des empereurs romains. À cette époque, il était extrait d'un mollusque, le murex, dont on raconte qu'il fallait traiter 12 000 coquillages pour en extraire 1,5 grammes. Pour cette raison, il était considéré comme un produit de luxe.
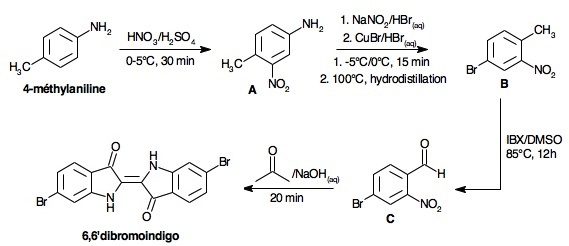
Il s'agit ici de réaliser la synthèse de ce colorant, dont le nom chimique est le 6,6'-dibromoindigo, en plusieurs étapes à partir de la 4-méthylaniline ![]() .
.
Cette molécule est de la famille de l'indigo (ou indigotine).
2.1 Principe de la synthèse
Le 6,6'-dibromoindigo s'obtient par une suite de réactions mettant en jeu des séparations d'isomères, des rendements parfois incertains et des conditions spéciales, ce qui accroît son coût.
Le schéma proposé est le suivant :
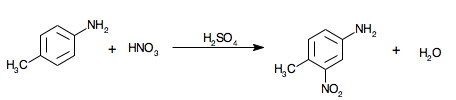
- 1 : substitution électrophile (nitration) de la 4-méthylaniline en milieu sulfurique, on obtient le composé A = 3-nitro-4-méthylaniline ;
- 2 : diazotation du composé A précédent, et substitution nucléophile du -N2+ par un -Br avec départ de diazote, on obtient le composé B = 2-nitro-4-bromotoluène ;
- 3 : oxydation ménagée de la chaîne latérale au cycle benzénique par l'IBX dans le DMSO, on obtient le composé C = 2-nitro-4-bromobenzaldéhyde[1][2] ;
- 4 : condensation aldolique du composé C précédemment obtenu sur l'acétone en présence d'hydroxyde de sodium, on obtient le composé D = 6,6'-dibromoindigo.
2.2 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Tous les intermédiaires réactionnels produits dans ces étapes sont des solides cancérigènes, il convient donc d'effectuer toutes ces manipulations en étant muni de gants et éventuellement de masque à poussières.
- Les acides bromhydrique, nitrique et sulfurique
 employés sont tous très corrosifs, les deux premiers émettant des vapeurs très corrosives, il conviendra de les utiliser sous hotte aspirante efficace et en étant muni de gants épais et de lunettes de protection.
employés sont tous très corrosifs, les deux premiers émettant des vapeurs très corrosives, il conviendra de les utiliser sous hotte aspirante efficace et en étant muni de gants épais et de lunettes de protection. - Le sulfate de cuivre (II)

 utilisé pour faire le cuivreux est nocif et polluant, on veillera à rejeter les résidus dans un bidon de récupération pour les sels métalliques.
utilisé pour faire le cuivreux est nocif et polluant, on veillera à rejeter les résidus dans un bidon de récupération pour les sels métalliques. - L'acétone

 est inflammable, on la manipulera loin de toute flamme et sous hotte aspirante.
est inflammable, on la manipulera loin de toute flamme et sous hotte aspirante.
2.3 Matériel nécessaire
Le matériel classique de chimie organique est nécessaire, à savoir : balance, spatules, baguettes en verre, barreaux aimantés, papier filtre, boîtes de Pétri ou cristallisoirs, trompe à eau (ou mieux, pompe à vide), papier pH, banc Kofler, pinces de fixation, supports élévateurs, étuve ou four...
Le détail du matériel utilisé dans chacune des étapes n'est pas réalisé car on utilise plusieurs fois les mêmes pièces de verrerie ; il suffit juste de les nettoyer durant les périodes de relâchement.
- Ballon tricol de 100 mL
- Réfrigérant de reflux
- Ampoule de coulée isobare de 25 mL ou 50 mL
- Barreau aimanté ovoïde
- Éprouvettes graduées de 25 mL et 50 mL
- Entonnoir en verre
- Béchers de 250 mL
- Ballon monocol de 100 mL
- Entonnoir Büchner
- Fiole à filtrer
- Agitateur magnétique chauffant ou chauffe ballon à agitation magnétique
- Bain de glace
2.4 Étape 1 : nitration de la 4-méthylaniline
La réaction 1 consiste en la dissolution à température ambiante de la 4-méthylaniline dans de l'acide sulfurique concentré, ce qui a pour effet de protonner l'amine et de solvater l'ion ammonium correspondant. On verse ensuite sur la solution obtenue, préalablement refroidie, un mélange sulfonitrique acide : il se produit une substitution électrophile du cycle aromatique qui est orientée en position méta (carbone en position 3) par rapport au -NH3+ et en position ortho (carbone en position 2) par rapport au -CH3, ce qui conduit au composé voulu, la fonction amine ne subit pas de protection prélable. Si on avait protégé l'amine, l'orientation de la substitution aurait été en ortho par rapport au méthyl, et en ortho par rapport à l'amide (les position para de chacun des substituants étant déjà occupées), ce qui aurait conduit à un mélange d'isomères, mais pas au produit attendu pour la suite. L'acide sulfurique sert également de catalyseur et de solvant pour la formation de l'ion nitronium -NO2+, on le placera en large excès. L'acide nitrique sera employé en léger excès, il n'y a pas de risque de polysubstitutions car les groupements -NH3+ et -NO2 sont des désactivants du cycle aromatique. L'amine sera régénérée de son sel par addition d'hydroxyde de sodium au milieu réactionnel.
Pour être large, on décide de travailler sur une quantité de matière de 4-méthylaniline de l'ordre de 50 mmol, ce qui nous permettra d'avoir suffisamment de produit pour la suite des évènements.
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4-méthylaniline | C7H9N | 107,17 | 99% | 5,413 g | - | 50 mmol | 1 | 43 | - | - | |
| Acide sulfurique concentré | H2SO4 | 98,08 | 96% | - | 24 mL | 430 mmol | 8,6 | - | - | 1,83 | |
| Acide nitrique concentré | HNO3 | 63,01 | 68% | - | 4 mL | 61 mmol | 1,22 | - | - | 1,41 | |
| Hydroxyde de sodium | NaOH | 40,00 | 10% mas. H2O | - | 20 mL | - | - | - | - | - |
- Dans un ballon bicol de 100 mL muni d'une ampoule de coulée isobare, d'une prise thermométrique et d'un barreau aimanté ovoïde, on introduit 5,413 g de 4-méthylaniline, puis, sous agitation, on verse goutte à goutte par l'intermédiaire de l'ampoule de coulée 20 mL d'acide sulfurique concentré tout en agitant et en refroidissant énergiquement (il se produirait sinon une réaction acidobasique très exothermique, pouvant atteindre 115°C, qui entraînerait la destruction complète de l'amine), la réaction de dégradation s'observe car le milieu réactionnel devient foncé jusqu'à noircir complètement, mais cette coloration ne gène en rien l'obtention du produit recherché. On agite la solution jusqu'à complète dissolution de la 4-méthylaniline et on refroidit le milieu réactionnel jusqu'à quasi prise en masse de la solution (environ 4°C).
- Le milieu réactionnel refroidi, on verse par l'intermédiaire de l'ampoule de coulée 8 mL d'un mélange sulfonitrique acide à 50/50 au goutte à goutte, en veillant bien à ce que la température ne dépasse pas les 10°C, refroidir avec un bain de glace et de sel le cas échéant. Une fois tout le mélange acide versé, on poursuit l'agitation 30 minutes en retirant le bicol du bain de glace, et en prenant garde à ce que la température ne dépasse pas les 30°C.
- Une fois la réaction finie, on verse le contenu du tricol dans un mélange de 50g d'eau et de 100g de glace sous agitation magnétique, un solide jaune-brun précipite abondamment. La solution ainsi obtenue est refroidie à 0°C et filtrée sous vide, le rétentat solide est lavé avec 20 mL d'eau glacée puis 20 mL de solution d'hydroxyde de sodium à 10% massique, puis une nouvelle fois 20 mL d'eau glacée. Le solide est essoré sous vide puis pesé, on peut éventuellement le purifier par recristallisation dans de l'eau, mais les analyses par RMN du proton et du carbone 13 montrent que le produit obtenu est pur.
2.5 Étape 2 : obtention du composé B
- Principe :
Cette étape consiste en la diazotation du composé obtenu précédemment en utilisant de l'acide nitreux formé in-situ par l'action de l'acide bromhydrique sur le nitrite de sodium, le milieu réactionnel étant maintenu à une température de l'ordre de -5°C à 0°C. Sur le diazonium ainsi obtenu, on réalise un couplage diazoïque en faisant réagir une dispersion de bromure cuivreux (CuBr, préparé extemporanément) dans l'acide bromhydrique. En pratique, on verse le diazonium froid dans le bromure cuivreux dispersé en solution et porté à ébullition, on isole le composé formé par hydrodistillation ex-situ. Il est important de maintenir le diazonium très froid pendant toute la durée de l'addition, la brusque élévation de température et l'utilisation d'un excès de bromure cuivreux permet de mettre toutes les chances de notre côté en prenant le diazonium "par surprise", la substitution s'effectue avec des rendements de l'ordre de 85% (selon publications analogues[3]).
On n'utilisera pas d'autre acide halohydrique que l'acide bromhydrique afin de ne pas avoir de réactions parasites avec l'acide chlorhydrique (le contre ion Cl- nucléophile au même titre que l'ion bromure) ou l'acide sulfurique sur le diazonium formé, et de former ainsi exclusivement le dérivé bromosubstitué.
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|
- Préparation du bromure cuivreux :
Le bromure cuivreux se prépare en milieu réducteur par action de l'acide bromhydrique sur le sulfate de cuivre (II) pentahydraté en solution aqueuse avec du sulfite de sodium. On utilisera de l'eau distillée bouillie et refroidie à l'abri de l'air ambiant, l'oxygène réagissant avec le cuivre à l'état d'oxydation +I, on veillera à ne pas mettre le sel cuivreux en contact de l'oxygène de l'air de manière prolongée.
- Préparation du diazonium :
Le diazonium du composé A est obtenu par dissolution dans de l'acide bromhydrique à froid et par addition de nitrite de sodium en solution aqueuse, à froid toujours.
- Réaction de substitution électrophile :
La réaction est obtenue par addition lente du diazonium maintenu froid dans le cuivreux porté à ébullition. L'isolement du composé C est obtenu par hydrodistillation du milieu réactionnel, il cristallise généralement dans le réfrigérant à eau.
2.6 Étape 3 : obtention du composé E
Cette réaction permet d'obtenir le 4-bromo-2-nitrobenzaldéhyde par action d'un oxydant récent (popularisé dans les années 2000) l'acide 2-iodoxybenzoïque dans le DMSO à chaud.
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|
2.7 Étape 4 : obtention du 6,6'-dibromoindigo
La réaction 4 consiste en la condensation aldolique de l'aldéhyde précédemment obtenu sur de l'acétone, réaction catalysée par de l'hydroxyde de sodium. (non testé à ce jour)
| Composé | Formule brute | M (g/mol) | Teneur/pureté | Masse | Volume | Qu. de mat. | Nb d'éq. | Tfus. (°C) | Téb. (°C) | d420 | Dangers |
|---|
2.8 Commentaires
- Les produits obtenus dans les étapes 1 et 2 ont été analysés par spectrométrie RMN du proton et du carbone 13.
- La 4-méthylaniline utilisée a été achetée auprès de la société Merck, l'acide nitrique et l'acide sulfurique auprès de la société Sigma-Aldrich.
2.9 Références
- ↑ Nicolaou K.C., Baran P.S., Zhong Y.L. ; J. Am. Chem. Soc., 2001, 123, 3183
- ↑ Le lien du site de William Erb : http://www.exchem.fr/ibx.htm
- ↑ http://www.orgsyn.org/