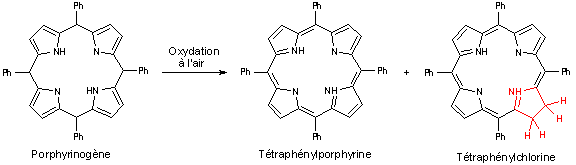
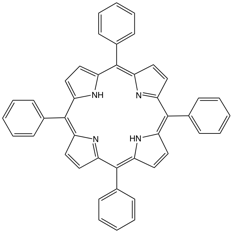
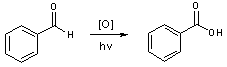Synthèse de la tétraphénylporphyrine
Il s'agit ici de synthétiser la 5,10,15,20-tétraphénylporphyrine (ou méso-tétraphénylporphyrine, TPP) avec la méthode d’Adler et Longo, la plus simple à mettre en oeuvre. Les porphyrines sont des molécules très présentes dans la nature sans lesquelles nous ne pourrions vivre : on trouve dans cette grande famille l'hémoglobine, la chlorophylle, la cyanocobalamine et bien d'autres.
À partir de 1935, Rothemund synthétise diverses porphyrines en faisant réagir un aldéhyde avec du pyrrole dans de la pyridine en tube scellé à des température variant de 140 à 220 °C pendant 24 à 48h, avec des rendements maximums d’une dizaine de pourcents[1][2][3][4]. Des conditions très dures limitant le choix des réactifs et donc le développement de cette réaction.
En 1967, Adler et Longo améliorent nettement la méthode de Rothemund en proposant de faire réagir un aldéhyde et du pyrrole au reflux de l’acide propanoïque. Dans ces conditions, la tétraphénylporphyrine est obtenue avec un rendement de 20%, la réaction étant applicable à l’échelle de quelques dizaines de grammes[5].
Sommaire
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Le pyrrole


 est un composé inflammable, toxique par inhalation et ingestion. Le port de gants est donc obligatoire et le travail sous hotte est très vivement conseillé. Le pyrrole pur se présente sous la forme d’un liquide incolore. Il est souvent coloré en marron par des impuretés dont on peut le débarrasser par simple distillation.
est un composé inflammable, toxique par inhalation et ingestion. Le port de gants est donc obligatoire et le travail sous hotte est très vivement conseillé. Le pyrrole pur se présente sous la forme d’un liquide incolore. Il est souvent coloré en marron par des impuretés dont on peut le débarrasser par simple distillation. - Le benzaldéhyde
 est un liquide incolore à odeur d’amande, nocif. Il est préférable de distiller le benzaldéhyde avant utilisation pour éviter la présence d’acide benzoïque.
est un liquide incolore à odeur d’amande, nocif. Il est préférable de distiller le benzaldéhyde avant utilisation pour éviter la présence d’acide benzoïque. - L’acide propanoïque
 est un liquide incolore d’une odeur désagréable assez forte et pouvant causer des brûlures par contact avec la peau. La manipulation sous hotte est vivement conseillée.
est un liquide incolore d’une odeur désagréable assez forte et pouvant causer des brûlures par contact avec la peau. La manipulation sous hotte est vivement conseillée. - Le méthanol


 est le plus simple des alcools. Il s’agit d’un liquide incolore, toxique par inhalation, ingestion et contact avec la peau.
est le plus simple des alcools. Il s’agit d’un liquide incolore, toxique par inhalation, ingestion et contact avec la peau. - La tétraphénylporphyrine ne semble pas toxique en elle-même mais sa manipulation devra toujours se faire avec des gants.
2 Synthèse
2.1 Matériels et produits
- Ballon bicol de 250 mL
- Réfrigérant à boules
- Ampoule de coulée de 10 mL
- Bain d’huile
- Agitateur magnétique chauffant
- Filtre en verre fritté n°3
- Système de filtration sous vide
2.2 Mode opératoire
- Réaliser le montage ci-contre.
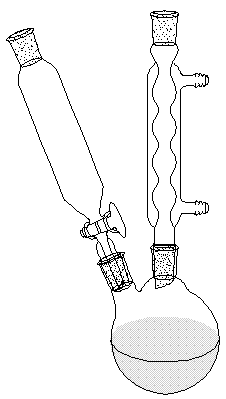 Montage à reflux : ballon bicol, réfrigérant à boules et ampoule de coulée.
Montage à reflux : ballon bicol, réfrigérant à boules et ampoule de coulée. - Placer 50 mL d’acide propanoïque
 dans le ballon puis 1,7 mL de benzaldéhyde
dans le ballon puis 1,7 mL de benzaldéhyde  , un barreau aimanté et porter au reflux (T > 140 °C) sous agitation.
, un barreau aimanté et porter au reflux (T > 140 °C) sous agitation. - Placer 1,6 mL de pyrrole


 dans l’ampoule de coulée et ajouter-le goutte-à-goutte une fois le milieu réactionnel au reflux.
dans l’ampoule de coulée et ajouter-le goutte-à-goutte une fois le milieu réactionnel au reflux. - Une fois l’addition terminée, laisser 30 min au reflux puis laisser revenir à température ambiante et refroidir dans un bain eau/glace.
- Filtrer sur filtre en verre fritté, rincer le solide par 4 fois 25 mL d’eau chaude puis 5 mL de méthanol.
- Laisser sécher à l’air libre.
3 Explications
3.1 Purification des réactifs
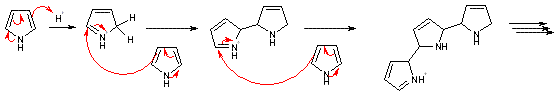
- Comme nous l’avons précisé auparavant, le pyrrole doit être distillé avant utilisation. En effet lors du stockage de ce composé, il développe une coloration allant du brun au noir, due à la présence de polymères de pyrrole. Ces polymères peuvent se former spontanément en présence de traces d’acide selon le mécanisme suivant, les dihydropyrroles obtenus pouvant également se ré-aromatiser en cours de réaction (pour compliquer encore un peu plus...) :
Le pyrrole distille à 130 °C sous pression atmosphérique. Il peut-être conservé en flacons bouché au réfrigérateur ou au congélateur pour limiter sa dégradation.
- De même, le benzaldéhyde doit être exempt d’acide benzoïque qui se forme par oxydation à l’air de l’aldéhyde sous l’action de la lumière :
Pour le purifier, une distillation sous vide convient tout à fait. Le produit distillé est conservé en flacon fermé hermétiquement à l’abri de la lumière dans un réfrigérateur.
3.2 La réaction
Dès l’addition des premières gouttes de pyrrole au milieu réactionnel, un changement de couleur (de l’orange au noir) traduit le déroulement d’une réaction
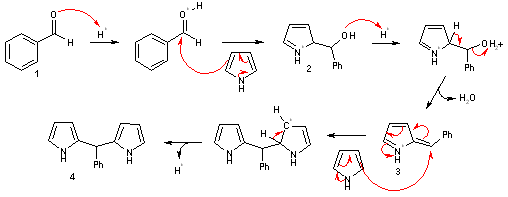
Actuellement, le mécanisme de la réaction du benzaldéhyde sur le pyrrole pour former la porphyrine est encore mal connu. Mais il est généralement admis que les premières étapes sont les suivantes[6] :
- La fonction carbonyle du benzaldéhyde est tout d’abord activée par protonation en milieu acide.
- Le pyrrole s’additionne ensuite pour donner l’alcool 2.
- La protonation de celui-ci puis l’élimination d’eau conduit à 3.
- L’addition d’une molécule de pyrrole sur 3 conduit au dipyrrométhane 4 après élimination d’un proton.
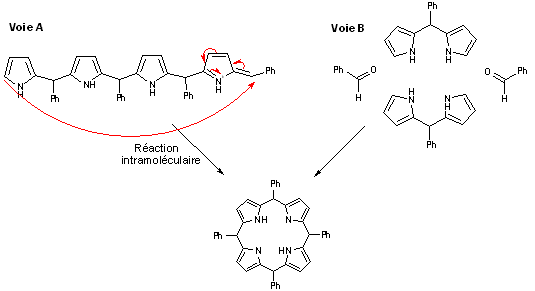
- À partir de là, les avis diffèrent :
- Il est possible de reprendre les mêmes étapes du schéma précédent pour jusqu’à former une molécule linéaire composée de quatre pyrroles et de quatre benzaldéhyde qui va par la suite réagit sur elle-même (Voie A).
- Il est également possible d'envisager la condensation de deux molécule de dipyrrométhane 4 avec deux molécules de benzaldéhyde permet de former la porphyrine (Voie B).
Dans tous les cas, on obtient le porphyrinogène qui va alors être oxydé en porphyrine par le dioxygène de l’air. Cependant, cette oxydation est souvent incomplète et l’on obtient comme sous-produit de réaction la chlorine correspondante :
De plus, des polymères de pyrrole (responsables de la couleur noire du milieu) sont également obtenus. Ils peuvent résulter de la condensation du pyrrole sur lui-même en milieu acide ou bien de la réaction du pyrrole avec le benzaldéhyde pour former des chaînes linéaires de ce type :
La réaction est ici menée dans l’acide propanoïque au reflux qui joue à la fois le rôle de donneur de protons pour la réaction et de solvant. De plus, si la porphyrine est soluble à chaud dans ce solvant, elle précipite par simple refroidissement ce qui permet de l’isoler par filtration. Le remplacement de l’acide propanoïque par l’acide éthanoïque ne permet généralement pas la précipitation de la porphyrine et complique le traitement (la purification par chromatographie est alors nécessaire). Notons tout de même que l’utilisation d’un mélange d’acide éthanoïque et de pyridine comme solvant permet l’obtention de la porphyrine avec des rendements sensiblement équivalents[7].
Le lavage à l’eau chaude permet d’éliminer l’acide propanoïque restant dans le solide tandis que le méthanol élimine les polymères de pyrrole et la chlorine formée.
On obtient ainsi la tétraphénylporphyrine sous la forme d’une poudre microcristalline violette avec un rendement variant entre 15 et 25%.
 Cristal de tétraphénylporphyrine obtenu par cristallisation dans le toluène. Taille réelle : 1x1 mm. |
4 Caractérisation
Il est possible de caractériser la tétraphénylporphyrine par diverses méthodes spectroscopiques :
- UV, dans CHCl3 :
| λ (nm) | ε (cm–1.mol–1.L) |
| 417 | 4,7.105 |
| 514 | 1,9.104 |
| 550 | 7,7.103 |
| 591 | 5,4.103 |
| 648 | 3,4.103 |
- IR :
| cm–1 | 3434 | 3314 | 3124 | 3100 | 1597 | 1492 | 1471 | 1364 | 1071 | 980 | 966 | 800 | 729 | 700 |
- RMN 1H dans CDCl3 :
| δ (ppm) | 8,85 (s, 8 H) | 8,3-8,15 (m, 8H) | 7,85-7,6 (m, 12H) | -2,75 (s, 2H, NH) |
- RMN 13C dans CDCl3 :
| δ (ppm) | 142,1 | 134,5 | 131,1 | 127,7 | 126,7 | 120,1 |
- CCM dans un mélange 60% dichlorométhane
 / 40% hexane
/ 40% hexane  :
:
La tétraphénylporphyrine présente un rapport frontal : Rf = 0,87.
5 Pour en savoir plus
- Consultez l'article sur les porphyrines.
- Voir aussi : La chlorophylle
6 Références
- ↑ Rothemund P. ; J. Am. Chem. Soc., 1935, 57, 2010
- ↑ Rothemund P. ; J. Am. Chem. Soc., 1936, 58, 625
- ↑ Rothemund P. ; J. Am. Chem. Soc., 1939, 61, 2912
- ↑ Rothemund P., Menotti A.R. ; J. Am. Chem. Soc., 1941, 63, 267
- ↑ Adler A. D., Longo F. R., Finarelli J. D., Goldmacher J., Assour J., Korsakoff J. ; J. Org. Chem., 1967, 32, 476
- ↑ Thèse présenté par Maryline Varamo pour obtenir le grade de Docteur en Sciences : Stratégies de synthèses de macrocyles tétrapyrroliques méso-substitués dissymétriques : application en thérapie photodynamique – N°8129 – Décembre 2005
- ↑ Treibs A., Häberle N. ; Liebigs Ann. Chem., 1968, 718, 183