Acide L-ascorbique
Un article du site scienceamusante.net.
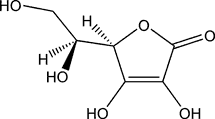
- Formule brute : C6H8O6
- Autre dénomination : vitamine C (pour son énantiomère lévogyre)
- N°CAS : 50-81-7
- N°CE : 200-066-2
Sommaire
[masquer]1 Propriétés physiques[1]
- Masse molaire : 176,124 g/mol
- Température de décomposition : 191°C
- Densité : 1,65
- Solubilité :
- Eau : 330 g/L
- Éthanol : soluble
- Éther diéthylique, benzène, chloroforme, éther de pétrole : insoluble
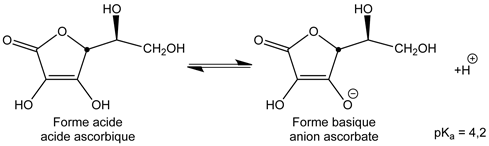
- Caractère acido-basique :
- Bien que n'ayant pas de fonction acide carboxylique, cette molécule possède un caractère acide faible :
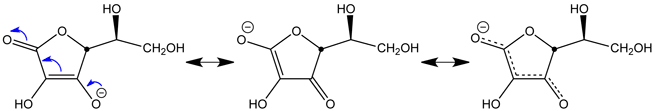
- L'anion ascorbate est stabilisé par délocalisation de la charge négative ; en voici les formes mésomères :
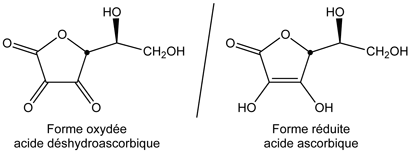
- Caractère oxydoréducteur :
- La vitamine C possède un caractère réducteur. Pour cela elle est utilisée comme additif alimentaire antioxydant, sous plusieurs formes dérivées : E300 (acide ascorbique), E301 (ascorbate de sodium), E302 (ascorbate de calcium), E303 (ascorbate de potassium)... Le potentiel standard E0 dépend du pH, des concentrations en formes acide ascorbique et ascorbate et de la température, d'après la relation de Nernst. D'autre part, il est difficile de trouver des valeurs expérimentales précises. Celles trouvées dans la littérature scientifique sont assez éparses comme : –0,2 V, +0,06 V, +0,08 V, +0,13 V, +0,39 V. Le couple oxydant-réducteur est : acide déshydroascorbique (Asc) / acide ascorbique (AscH2).
2 Classes et catégories de dangers - Étiquetage
Conforme au règlement CLP/SGH
Non classifié.
3 Où s'en procurer ?
- Auprès des vendeurs de matériel et produits spécialisés.
- Alimentation : utilisé comme antioxydant, additif E300.
- Pharmacie
4 Références
- Aller ↑ CRC Handbook of Chemistry and Physics, David R. Lide, 88th edition (2007-2008). ISBN 978-0-8493-0488-0