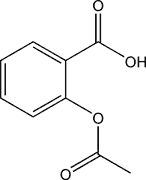
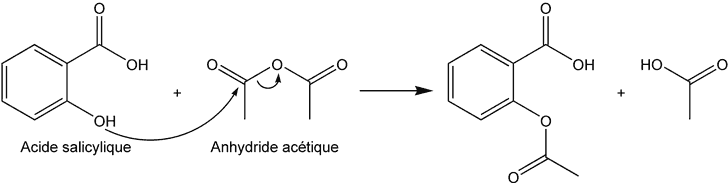
Synthèse de l'aspirine
C'est le médicament le plus consommé au monde, avec une consommation annuelle estimée à 40 000 tonnes ; pourtant d'autres molécules au effets similaires et avec moins d'effets secondaires sont disponibles (Ibuprofène, Paracétamol...) mais, culturellement, cela reste LE médicament que tout le monde connaît. En France par exemple, 237 médicaments commercialisés contiennent de l'aspirine.
Attention cependant à ne pas prendre de l'aspirine à tout va, car elle provoque quelques effets secondaires qui peuvent être indésirables :
- Elle fluidifie le sang, et donc pas recommandée pour les personnes hémophiles, qui ont du mal à cicatriser, ou les femmes en fin de cycle menstruel.
- Elle peut provoquer des acidités d'estomac chez certaines personnes, voire des ulcères.
La synthèse suivante est un grand classique pour des étudiants d'université ou d'école de chimie.
Sommaire
1 Synthèse à partir de l'acide salicylique
Pour une réaction d'estérification totale (on parlera ici d'O-acylation), on préfèrera utiliser de l'anhydride éthanoïque ![]()
![]()
![]() ou du chlorure d'acétyle
ou du chlorure d'acétyle ![]() . En effet, l'acide éthanoïque ne ferait qu'une estérification classique (réaction équilibrée).
. En effet, l'acide éthanoïque ne ferait qu'une estérification classique (réaction équilibrée).
1.1 Avec l'anhydride acétique
- Dans un ballon rodé muni d'un réfrigérant, placer 10 g d'acide salicylique et 30 mL d'anhydride éthanoïque


 . En guise de catalyseur, ajouter quelques gouttes d'acide sulfurique
. En guise de catalyseur, ajouter quelques gouttes d'acide sulfurique  ou un peu d'acide paratoluènesulfonique
ou un peu d'acide paratoluènesulfonique  (APTS).
(APTS). - Placer le ballon, sous agitation magnétique, dans un bain marie à 60°C pendant 20 minutes.
- Verser le contenu du ballon de réaction dans un bécher contenant de l'eau et des morceaux de glace, ceci pour neutraliser l'excès d'anhydride acétique, et pour faire cristalliser le produit.
- Refroidir jusque 10°C environ la solution, des cristaux se sont formés depuis la précédente étape.
- Filtrer sur verre fritté ou sur büchner pour récupérer l'aspirine produite ; la laver à l'eau distillée très froide.
1.2 Avec le chlorure d'acétyle
- Dissoudre 1 équivalent (molaire) d'acide salicylique dans du toluène


 ou du dichlorométhane anhydre
ou du dichlorométhane anhydre  à raison de 0,25 mmol/mL et placer rapidement le tout à 0°C sous atmosphère sèche.
à raison de 0,25 mmol/mL et placer rapidement le tout à 0°C sous atmosphère sèche. - Ajoutez deux à trois équivalents de triéthylamine ou autre base non nucléophile (pyridine) au mélange réactionnel, préférez une base séchée sur tamis moléculaire.
- Ajoutez goutte à goutte 1,2 équivalent (molaire) de chlorure d'acétyle
 sous vive agitation, un échauffement devrait se produire ainsi que l'apparition d'un précipité blanc.
sous vive agitation, un échauffement devrait se produire ainsi que l'apparition d'un précipité blanc. - En fin d'addition, on laisse la réaction revenir à température ambiante et l'agitation est poursuivie sur la nuit.
- La réaction est traitée par addition à froid d'une solution concentrée de chlorure d'ammonium.
- Les deux phases sont séparées puis la phase aqueuse est extraite deux fois à l'acétate d'éthyle.
- Les phases organiques sont mélangées, le tout est séché sur sulfate de sodium ou de magnésium puis le solvant est évaporé à l'aide d'un évaporateur rotatif pour laisser apparaître un solide blanc.
2 Purification de l'aspirine
L'aspirine (acide acétylsalicylique) obtenue doit être purifiée. La méthode la plus adaptée est la recristallisation. Elle est peu soluble dans l'eau froide.
- Dans un montage de chauffage à reflux, introduire l'aspirine, et la recouvrir d'un minimum d'eau.
- Chauffer et agiter, à reflux de l'eau, ajouter de l'eau distillée tant que les cristaux ne sont pas intégralement dissous.
- Attendre la dissolution de tous les cristaux, à chaud.
- Une fois dissout, verser le contenu de l'erlenmeyer dans lequel on a effectué la dissolution à chaud dans un bécher, et laisser le contenu du bécher refroidir lentement jusqu'à la température ambiante. La cristallisation opère lentement, mais de magnifiques cristaux se forment. Refroidir dans de la glace ensuite.
- Après cristallisation, filtrer sur verre fritté ou sur büchner pour récupérer l'aspirine purifiée.
Votre aspirine est maintenant d'une grande qualité ! Cependant il n'est pas conseillé de l'utiliser comme médicament.
3 Identification, contrôle de pureté
Vous pouvez cependant contrôler sa pureté par plusieurs méthodes.
3.1 Chromatographie sur couche mince (CCM)
Utiliser une aspirine pure de pharmacie pour la référence.
- Eluant conseillé : 6 mL d'acétate de butyle + 4 mL de cyclohexane



 + 1 mL d'acide formique
+ 1 mL d'acide formique 
- Diluer un peu de votre aspirine dans un pilulier avec ce mélange ; de même pour l'aspirine de référence.
- Faire les dépôts avec un tube capillaire à 1 cm du bas d'une plaque de silice.
- Dans un pot à CCM, placer l'éluant, placer la plaque et fermer le pot.
- Après migration sur plaque de silice, révéler les taches avec une lampe UV.
3.2 Température de fusion
Mesurée avec un banc Kofler ou un tube de Thiel : 135-138°C
3.3 Spectre RMN 1H
à compléter
4 Références