Solution de cobalt
Un article du site scienceamusante.net.
Révision de 10 avril 2012 à 10:48 par WikiSysop (discuter | contributions)
Cette expérience illustre la sensibilité d'un équilibre chimique face à la température. Une variation de température se voit alors par le changement de couleur d'une solution de chlorure de cobalt. C'est donc ici un indicateur coloré de température qui utilise le même produit que pour le papier de cobalt.
Sommaire
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Portez des lunettes, gants et masque pour ne pas être en contact avec le chlorure de cobalt


 .
.
2 Matériel
- Éthanol ou bien propan-2-ol


- Eau distillée
- Chlorure de cobalt CoCl2



- 3 tubes à essais identiques
- Bec Bunsen ou chalumeau
3 Protocole
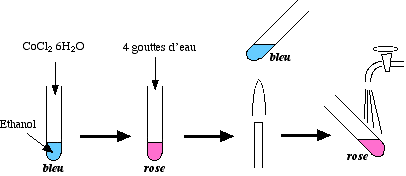
- Prendre 3 tubes à essais identiques :
- Dans le premier : mettre un peu d'eau et une pincée de poudre de chlorure de cobalt


 . Agiter pour dissoudre. La couleur est rose.
. Agiter pour dissoudre. La couleur est rose. - Dans les deux autres, faire pareil mais en remplaçant l'eau par de l'alcool (éthanol ou propan-2-ol)

 . La couleur est bleue.
. La couleur est bleue.
- Dans le premier : mettre un peu d'eau et une pincée de poudre de chlorure de cobalt
- Conserver un tube rose et un bleu comme témoins.
- Verser prudemment trois ou quatre gouttes d'eau (pas trop) dans l'une des solutions bleues, en agitant. La solution vire au rose. Arrêter avant d'atteindre la teinte rose du témoin aqueux.
- Pour montrer que la réaction peut être inversée :
- Chauffer le tube devenu rose au bec Bunsen : la solution redevient bleue
- Refroidir le tube bleu sous le robinet : la solution redevient rose.
- On peut répéter ceci indéfiniment.
4 Explications
- En réalité le chlorure de cobalt CoCl2 que vous utilisez est très certainement hydraté, c'est à dire que sa formule est CoCl2,6H2O. Les 6 molécules d'eau sont fixées (complexées) au chlorure de cobalt. Il se présente sous forme d'une poudre rose. Si jamais vous utilisez un chlorure de cobalt anhydre (couleur bleue, voir le papier de cobalt), ce n'est pas bien grave puisque vous ajoutez de l'eau dans cette expérience.
- Le chlorure de cobalt CoCl2,6H2O


 est une poudre rose qui se dissout dans l'eau en formant une solution rose contenant le cation [Co(H2O)6]2+ de couleur rose pâle.
est une poudre rose qui se dissout dans l'eau en formant une solution rose contenant le cation [Co(H2O)6]2+ de couleur rose pâle.
- CoCl2.6H2O → [Co(H2O6]2+ + 2 Cl–
- Dans l'alcool (éthanol ou propan-2-ol), le même CoCl2,6H2O forme une solution bleue, selon l'équation :
- 2 CoCl2.6H2O → [Co(H2O)6]2+(rose) + [CoCl4]2–(bleu) + 6 H2O
- La couleur bleue de [CoCl4]2– cache celle de [Co(H2O)6]2+ en solution. Mais si on ajoute de l'eau H2O à la solution alcoolique, elle va rosir peu à peu, selon une équation équilibrée :
- [CoCl4]2–(bleu) + 6 H2O ⇄ [Co(H2O)6]2+(rose) + 4 Cl–
- Cette réaction est exothermique (dégage de la chaleur) dans le sens gauche → droite. Mais elle conduit à une diminution du nombre d'espèces indépendantes (7 espèces à gauche contre 5 à droite) et à une diminution de l'entropie. La réaction dans le sens droite → gauche (endothermique, qui absorbe de la chaleur) est donc favorisée à haute température, puisqu'elle conduit à une augmentation de l'entropie.
- On voit donc que la température peut avoir une influence sur une réaction lorsque celle-ci est équilibrée et qu'il existe une variation d'enthalpie (chaleur) et d'entropie.
Merci à Maurice Cosandey pour cette contribution tirée de ses vingt démonstrations faciles à faire en classe.