Paramagnétisme du dioxygène
Un article du site scienceamusante.net.
Révision de 5 septembre 2014 à 14:50 par WikiSysop (discuter | contributions)
Il s'agit d'une expérience qui montre que le dioxygène est une substance paramagnétique, prouvant ainsi que la molécule possède des couches électroniques ouvertes.
1 Précautions

Basse température

|
| GHS03 |
- Attention aux basses températures
 , pouvant congeler ("brûler", par abus de langage) les mains ou les tissus.
, pouvant congeler ("brûler", par abus de langage) les mains ou les tissus. - Le dioxygène
 étant un excellent comburant, il faut éviter le contact avec des gaz combustibles
étant un excellent comburant, il faut éviter le contact avec des gaz combustibles  (dihydrogène, gaz naturel, propane, butane, etc.) car le mélange peut devenir extrêmement explosif (voir combustion : le triangle du feu).
(dihydrogène, gaz naturel, propane, butane, etc.) car le mélange peut devenir extrêmement explosif (voir combustion : le triangle du feu). - Les champs magnétiques élevés peuvent causer des dommages irréversibles sur des appareils électroniques ou informatiques (stimulateurs cardiaques, supports informatiques magnétiques, etc.).
2 Matériel
- Azote liquide

- Papier aluminium
- Verre de montre
- Aimant au néodyme, ou de forte intensité

3 Protocole expérimental
- Tout d'abord, se reporter à l'expérience de distillation cryogénique du dioxygène de l'air, pour voir comment obtenir du dioxygène liquide pur
 .
. - Récupérer le dioxygène liquide dans un verre de montre.
- Approcher, par dessous du verre de montre, l'aimant au néodyme
 et observer que les gouttes de dioxygène liquide sont attirées par l'aimant. On peut déplacer le dioxygène en déplaçant l'aimant.
et observer que les gouttes de dioxygène liquide sont attirées par l'aimant. On peut déplacer le dioxygène en déplaçant l'aimant. - On peut éventuellement observer que ce phénomène ne se produit pas avec des gouttes de diazote liquide dans les mêmes conditions.
4 Explications
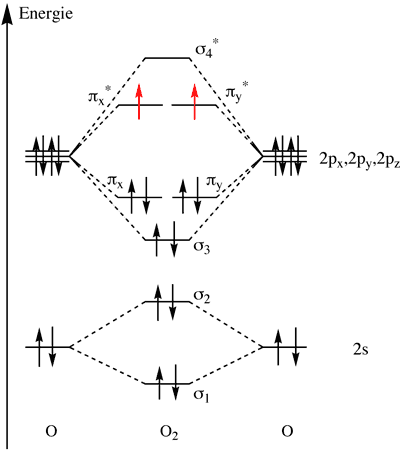
Diagramme d'orbitales moléculaires du dioxygène.
- La molécule de dioxygène, O2, possède des couches électroniques ouvertes, c'est à dire où les électrons ne sont pas regroupés par paire. Plus exactement, il existe deux couches ouvertes, soit deux électrons célibataires dans la molécule. Comme les deux électrons ont le même spin, l'état fondamental du dioxygène est un triplet de spin. Ainsi, le dioxygène est paramagnétique : il est attiré par un aimant.
- Le paramagnétisme du dioxygène permet de montrer que le modèle de Lewis est simpliste et faux dans ce cas, car celui-ci prévoit une molécule O2 avec une double liaison et deux doublets d'électrons sur chaque atome d'oxygène. D'après le diagramme des orbitales moléculaires ci-dessus, on voit qu'il s'agit plutôt d'un diradical.
- Le fait que la molécule soit un diradical dans un état triplet, donne au dioxygène un caractère de molécule très réactive. On ne s'en rend peut-être pas compte, car le dioxygène que nous respiront est dilué à environ 20% dans l'air, mais c'est bien le dioxygène qui est responsable de l'oxydation des aliments, du rancissement des graisses, et du fait que les combustions soint facilement réalisables dans l'air. On peut voir l'effet du dioxygène pur dans l'expérience de la distillation cryogénique du dioxygène de l'air et dans l'expérience de combustion dans l'oxygène pur.
- Le diazote N2, quand à lui, a toutes ses couches électroniques fermées, aucun électron n'est célibataire. Il n'est donc pas attiré par un aimant car il n'est pas paramagnétique. Il est diamagnétique, et serait même faiblement repoussé par un aimant de très forte intensité.
5 Liens
- Wikipédia - Paramagnétisme : http://fr.wikipedia.org/wiki/Paramagnétisme
- Un travail d'un étudiant avec des photos de l'expérience, details de la réalisation pratique, etc.
