La caféine
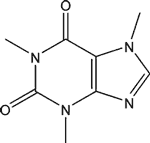
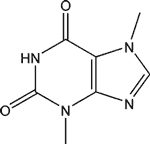
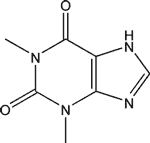
La caféine ![]() (connue également sous les noms de théine, guaranine, méthylthéobromine, 1,3,7-triméthylxanthine) a pour formule brute C8H10N4O2. Elle présente des propriétés proches de celles des alcaloïdes, mais on considère souvent qu'elle ne fait pas partie de cette famille en raison de son pH, mais de celle des méthylxanthines, aux côtés de la théobromine et de la théophylline, molécules proches que l'on retrouve également dans plusieurs plantes.
(connue également sous les noms de théine, guaranine, méthylthéobromine, 1,3,7-triméthylxanthine) a pour formule brute C8H10N4O2. Elle présente des propriétés proches de celles des alcaloïdes, mais on considère souvent qu'elle ne fait pas partie de cette famille en raison de son pH, mais de celle des méthylxanthines, aux côtés de la théobromine et de la théophylline, molécules proches que l'on retrouve également dans plusieurs plantes.
La caféine fut découverte en 1819 par Runge et Von Giese. La théine, extraite du thé par Oudry en 1827, s'avéra être exactement la même molécule, seule la matière première utilisée lors de l'extraction les distingue. Cependant, ceci n'ayant été démontré qu'en 1838, le nom "théine" subsista, passant souvent pour une espèce chimique différente de la caféine. [1]
La caféine se trouve évidemment dans le café, dont elle est la principale responsable de l'effet excitant, mais il est également possible de l'extraire du thé, du guarana (plante originaire d'Amazonie, l'espèce la plus riche en caféine connue), du cacao ou encore de la noix de kola. À titre indicatif, dans un volume de 50 mL (soit une tasse à café), on retrouve les quantités suivantes de caféine [2] :
- Café en grain moulu : 75 à 100 mg
- Café instantané : 60 à 99 mg
- Café décaféine : 2 à 4 mg
- Thé : 30 à 60 mg
- Cacao : 10 à 40 mg
- Boissons gazeuses "Cola" : 20 à 30 mg
La teneur en caféine varie considérablement selon l'origine du café : l'arabica contient entre 0,8 et 1,5% de caféine, alors que le robusta (canephora) atteint les proportions de 1,6 à 3 %. Il faut également noter qu'une partie de la caféine est détruite lors de la torréfaction des graines de café vert, qui peuvent en contenir plus de 5 % pour les variétés robusta. Dans le protocole suivant, on aura donc tout intérêt à utiliser des graines de café vert (non torréfiées) de variété robusta, que l'on peut se procurer dans les brûleries de café. Ce protocole peut également s'appliquer aux feuilles de thé, le plus riche en caféine étant le thé noir.
Sommaire
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- La caféine pure
 en dangereuse car elle a un effet important sur l'organisme : insomnie, palpitations cardiaques, nausées, anxiété, polyurie. La dose létale estimée (quantité moyenne mortelle) est entre 5 et 10 g pour un adulte. Ne pas goûter la caféine pure ! Pris à forte dose, on peut considérer le café (et la caféine) comme une drogue, d'après la définition[3] : "toute substance toxique agissant sur le système nerveux et dont l'usage abusif provoque des perturbations graves, physiques et mentales, et un état de dépendance et d'accoutumance."
en dangereuse car elle a un effet important sur l'organisme : insomnie, palpitations cardiaques, nausées, anxiété, polyurie. La dose létale estimée (quantité moyenne mortelle) est entre 5 et 10 g pour un adulte. Ne pas goûter la caféine pure ! Pris à forte dose, on peut considérer le café (et la caféine) comme une drogue, d'après la définition[3] : "toute substance toxique agissant sur le système nerveux et dont l'usage abusif provoque des perturbations graves, physiques et mentales, et un état de dépendance et d'accoutumance." - Le dichlorométhane
 est un solvant suspecté de provoquer le cancer à long terme. Afin de manipuler en toute sécurité, il est donc impératif de travailler sous hotte, avec l'équipement de protection habituel requis (blouse, lunettes et gants). Il existe plusieurs solvants de substitution : le chloroforme CHCl3
est un solvant suspecté de provoquer le cancer à long terme. Afin de manipuler en toute sécurité, il est donc impératif de travailler sous hotte, avec l'équipement de protection habituel requis (blouse, lunettes et gants). Il existe plusieurs solvants de substitution : le chloroforme CHCl3 
 et le trichloroéthylène
et le trichloroéthylène 
 sont des bons solvants de la caféine, mais présentent la même nocivité que le dichlorométhane. L'acétate d'éthyle
sont des bons solvants de la caféine, mais présentent la même nocivité que le dichlorométhane. L'acétate d'éthyle 
 convient également, bien que la solubilité de la caféine y soit légèrement inférieure. Celui-ci présente l'avantage d'être moins nocif, et plus difficile à évaporer.
convient également, bien que la solubilité de la caféine y soit légèrement inférieure. Celui-ci présente l'avantage d'être moins nocif, et plus difficile à évaporer. - L'eau de brome


 est un réactif toxique et polluant. On pourra lui préférer l'eau de chlore
est un réactif toxique et polluant. On pourra lui préférer l'eau de chlore  , qui reste toutefois assez toxique. Pour préparer 100 mL d'eau de chlore, mélanger 20 mL d'eau de Javel
, qui reste toutefois assez toxique. Pour préparer 100 mL d'eau de chlore, mélanger 20 mL d'eau de Javel 
 du commerce à 3 % de chlore actif avec 60 mL d'eau distillée. Neutraliser ensuite par l'ajout progressif (attention aux projections !) de 20 mL d'acide chlorhydrique
du commerce à 3 % de chlore actif avec 60 mL d'eau distillée. Neutraliser ensuite par l'ajout progressif (attention aux projections !) de 20 mL d'acide chlorhydrique  à 2 mol/L. Un peu de dichlore gazeux
à 2 mol/L. Un peu de dichlore gazeux 

 peut se dégager, il est donc impératif de travailler sous hotte. Cette solution s'altère rapidement à l'air et à la lumière, il ne faut donc la préparer qu'au moment de s'en servir.
peut se dégager, il est donc impératif de travailler sous hotte. Cette solution s'altère rapidement à l'air et à la lumière, il ne faut donc la préparer qu'au moment de s'en servir. - L'utilisation d'une lampe à ultraviolet
 nécessite des protections. Utiliser des lunettes prévues à cet effet, ne pas regarder la source lumineuse et limiter la durée de l'exposition.
nécessite des protections. Utiliser des lunettes prévues à cet effet, ne pas regarder la source lumineuse et limiter la durée de l'exposition.
2 Matériel
2.1 Pour l'extraction
- Ballon en Pyrex® de 500 mL
- Réfrigérant ascendant
- Entonnoir et filtre, si possible büchner et fiole à vide
- Béchers de 250 mL ou plus
- Éprouvette graduée de 100 mL
- Ampoule à décanter de 250 mL
- Montage de distillation ou, mieux, évaporateur rotatif
- Cristallisoir
- Plaque de verre ou de métal de dimension suffisante pour recouvrir l'ouverture du bécher
- Café ou thé
- Eau distillée
- Dichlorométhane CH2Cl2

- Carbonate de calcium CaCO3
- Chlorure de calcium anhydre CaCl2
 ou sulfate de magnésium anhydre MgSO4
ou sulfate de magnésium anhydre MgSO4 
- Acétone


2.2 Pour l'identification
- Plaque de chromatographie ou papier filtre
- Bocal à confiture
- Sèche-cheveux
- Lampe ultraviolette pour révélation de plaques chromatographiques
- Caféine pure de référence

- Éthanol

- Eau de brome


 ou eau de chlore
ou eau de chlore 
- Ammoniaque


- Verre de montre
3 Protocole expérimental
3.1 Extraction
- La première étape consiste en une extraction solide/liquide par décoction. Pour cela, verser 50 g de café réduit en poudre dans le ballon de 500 mL. Ajouter 300 mL d'eau et 25 g de carbonate de calcium. L'idéal est d'obtenir un pH de 9 (L'acide gallique présent dans le café sera sous une forme peu soluble dans le dichlorométhane lors de l'étape suivante.) Munir le ballon du réfrigérant ascendant, de façon à pouvoir chauffer sans perte de matière. Maintenir le mélange à ébullition douce durant deux heures.
- Au terme de cette décoction, filtrer sur büchner et recueillir le jus marron. Laisser refroidir la solution.
- La seconde étape est une extraction liquide/liquide. Introduire 150 mL du jus marron dans l'ampoule à décanter et ajouter 50 mL de dichlorométhane
 . Agiter vigoureusement, en dégazant régulièrement. La caféine change alors de phase et passe dans le dichlorométhane. Laisser décanter (sans bouchon) et récupérer la phase organique (le dichlorométhane) d'une part, et la phase aqueuse d'autre part. Sur cette phase aqueuse, refaire une extraction avec 50 mL de dichlorométhane
. Agiter vigoureusement, en dégazant régulièrement. La caféine change alors de phase et passe dans le dichlorométhane. Laisser décanter (sans bouchon) et récupérer la phase organique (le dichlorométhane) d'une part, et la phase aqueuse d'autre part. Sur cette phase aqueuse, refaire une extraction avec 50 mL de dichlorométhane  , de façon à extraire le maximum de caféine. Répéter la décantation et une nouvelle extraction des 150 mL de phase aqueuse avec 50 mL de dichlorométhane.
, de façon à extraire le maximum de caféine. Répéter la décantation et une nouvelle extraction des 150 mL de phase aqueuse avec 50 mL de dichlorométhane. - Une fois ces extractions réalisées, regrouper les phases organiques dans un erlenmeyer. Afin de sécher la phase organique (éliminer les traces d'eau), ajouter, spatule par spatule dans l'erlen, du chlorure de calcium anhydre
 ou du sulfate de magnésium anhydre
ou du sulfate de magnésium anhydre  , tout en remuant, jusqu'à ce que le sel versé ne s'agglomère plus au fond de l'erlen mais reste mobile. Les molécules d'eau sont captées par le sel anhydre. Filtrer la solution et récupérer la phase organique dans un ballon sec rodé.
, tout en remuant, jusqu'à ce que le sel versé ne s'agglomère plus au fond de l'erlen mais reste mobile. Les molécules d'eau sont captées par le sel anhydre. Filtrer la solution et récupérer la phase organique dans un ballon sec rodé. - Procéder à l'évaporation du dichlorométhane au moyen d'un évaporateur rotatif (de type Rotavapor®) ou par distillation du solvant dans un montage de distillation simple (ballon + réfrigérant descendant) en surveillant la température (si celle-ci était trop élevée la caféine serait détruite).
- Une fois que tout le solvant est évaporé, il reste au fond du ballon une poudre jaune pâle : il s'agit de caféine brute.
4 Purification
Deux méthodes permettent de purifier cette caféine : par recristallisation ou par sublimation.
4.1 Par recristallisation
- Dissoudre la caféine brute dans quelques mL d'acétone

 , dans le cristallisoir.
, dans le cristallisoir. - Laisser l'acétone s'évaporer (sous hotte !), ce qui provoque la cristallisation de la caféine en petites aiguilles blanches.
4.2 Par sublimation
- Introduire la caféine brute dans un bécher en Pyrex®, qui sera fermé en déposant une plaque de verre ou de métal à sa surface.
- Chauffer doucement le bécher : la caféine se sublime, sous forme d'abondantes vapeurs blanches à l'intérieur du bécher. Une fois que tout la caféine brute s'est sublimée, stopper le chauffage. La caféine se dépose alors sur les parois du bécher et de la plaque sous formes d'aiguilles.
5 Identification
Deux tests permettent d'identifier la caféine : une chromatographie sur couche mince ou le test de la muréxoïne.
5.1 Chromatographie sur couche mince (CCM)
- Préparer une solution d'éluant en mélangeant 12 mL d'éthanol
 et 8 mL d'eau distillée. Ceci constituera la solution S0.
et 8 mL d'eau distillée. Ceci constituera la solution S0. - Diluer la caféine extraite du café dans le plus petit volume d'éthanol pur possible (de 2 à 5 mL selon la quantité). Ceci constituera la solution S1.
- De la même façon diluer 1 g de caféine de référence, c'est à dire la caféine pure du commerce, dans un même volume d'éthanol pur. Ceci constituera la solution S2.
- Sur une plaque chromatographique en silice (ou le papier filtre, à défaut), tracer au crayon deux repères de part et d'autre qui serviront à déposer les gouttes à la même hauteur, à environ 2 cm du bas.
- Sur cette ligne imaginaire, déposer une goutte de solution S1 côté gauche, puis une goutte de solution S2 côté droit, en évitant l'étalement de la goutte (utiliser un tube capillaire de préférence). Sécher la plaque au sèche-cheveux, puis déposer à nouveau une goutte de chaque solution au même endroit. Sécher à nouveau. Répéter l'opération (dépôt + séchage) jusqu'à avoir déposé une dizaine de gouttes. (Il est impératif que les zones de dépôt soient suffisamment espacées pour qu'elles ne se touchent pas après que les dix gouttes aient été appliquées !)
- Introduire dans le bocal à confiture quelques mL de solution d'éluant S0 afin de remplir le bocal sur 0,5 cm de hauteur. Déposer soigneusement la plaque chromatographique dans le bocal, les zones de dépôt étant en bas de la plaque. (Attention : la solution d'éluant S0 doit être en dessous de la ligne de dépôt, les taches ne devant pas tremper dans la solution !).
- Fermer le bocal avec son couvercle et ne pas toucher au bocal durant une heure, afin de laisser les espèces migrer sur la plaque chromatographique.
- À ce terme, ouvrir le bocal, retirer la plaque, la sécher entièrement au sèche-cheveux, puis l'observer sous lampe ultraviolette : si la manipulation a été correctement effectuée, on doit observer deux traînées s'arrêter à la même hauteur, ce qui prouve qu'il s'agit de la même molécule.
5.2 Test de la muréxoïne
- Dans un petit bécher, déposer la caféine extraite du café et ajouter 10 mL d'eau de brome


 ou d'eau de chlore
ou d'eau de chlore  .
. - Chauffer très doucement, jusqu'à évaporation complète de la solution (sous hotte aspirante). Il reste un résidu rougeâtre, constitué de diméthylalloxane.
- Enduire l'intérieur d'un verre de montre d'ammoniaque

 au moyen d'un papier absorbant.
au moyen d'un papier absorbant. - Retourner ce verre de montre au-dessus du résidu : au contact des vapeurs d'ammoniaque, le résidu prend une coloration pourpre, due à la formation de muréxoïne, ce qui prouve la présence initiale de caféine.
6 Explications
- Toutes les extractions consistent à utiliser habilement les différences de solubilité selon les molécules, la température ou les solvants, afin de sélectionner les espèces à extraire. Dans le cas présent, l'extraction est basée sur une propriété de la caféine, rencontrée chez de nombreuses molécules, qui est la suivante : la caféine est peu soluble dans l'eau froide (22 g/L à 25°C), mais l'est considérablement dans l'eau chaude (455 g/L à 65°C). De plus, cette molécule est très soluble dans plusieurs solvants organiques, dont le dichlorométhane utilisé ici (142 g/L à 25°C). Grâce à cette différence de solubilité selon la température, on réalise tout d'abord une décoction de la matière première solide, le café, dans l'eau bouillante. La caféine, alors très soluble, passe donc en solution aqueuse. Mais, la température diminuant, la caféine voit sa solubilité décroître. L'ajout de dichlorométhane dans la phase aqueuse refroidie permet donc à la caféine de s'y dissoudre efficacement, celle-ci y étant bien plus soluble que dans l'eau froide. De cette façon, il a été possible de sélectionner une molécule et de l'extraire. Mais d'autres espèces chimiques du café pourraient présenter la même propriété : c'est justement le cas des colorants végétaux contenus dans cette plante. Afin d'éviter le passage de ces colorants dans le solvant organique, une seconde parade est utilisée. En effet, la solubilité dépend également d'un autre paramètre : le pH, c'est à dire le caractère acide ou basique de la solution. En modifiant le pH, par l'ajout de carbonate de sodium
 , la solution est rendue légèrement basique (pH = 9). Les colorants réagissent alors, devenant bien plus solubles en phase aqueuse que dans la phase organique, et l'on évite ainsi de les extraire en même temps que la caféine, qui ne réagit pas de cette façon en milieu basique.
, la solution est rendue légèrement basique (pH = 9). Les colorants réagissent alors, devenant bien plus solubles en phase aqueuse que dans la phase organique, et l'on évite ainsi de les extraire en même temps que la caféine, qui ne réagit pas de cette façon en milieu basique. - On peut noter ici que ces techniques d'extractions sont valables pour un très grand nombre de substances naturelles, animales ou végétales : l'eugénol du clou de girofle, nicotine du tabac, et autres drogues, parfums, médicaments...
- D'autre part, il existe d'autres manières de faire du café, et donc d'extraire la caféine :
- par infusion-filtration (français) où l'eau chaude coule à travers le café contenu dans un filtre,
- par percolation (expresso, italien) où de la vapeur d'eau passe sous pression à travers une galette de café moulu,
- par infusion-décantation (grec, turc) où le café en poudre est mélangé à l'eau chaude,
- par décoction où la poudre est mélangée à de l'eau portée à ébullition (mais le goût qui en résulte est rarement agréable, d'où l'expression "café bouillu, café foutu" !)
- Dans le café décaféiné, la caféine est retirée par extraction avec des solvants chlorés, ce qui est très discutable du point de vue du respect de l'environnement et des pratiques alimentaires. Contrairement à une idée répandue, ce n'est pas la caféine qui fait le goût du café, mais bien d'autres molécules. Cependant, de plus en plus l'extraction de la caféine se fait industriellement par le dioxyde de carbone CO2 à l'état supercritique. C'est procédé qui fonctionne parfaitement bien et qui est déjà utilisé dans bon nombre d'usines. L'avantage fondamental est que le café extrait ne contient aucun résidu de solvant.
- La réaction de la muréxoïne fait appel à deux réactions : la première consiste en une oxydation des chaînes latérales du noyau uracile de la caféine, en présence de dichlore en solution aqueuse. Il y a production de diméthylalloxane et de méthylurée, cette dernière molécule n'intervenant pas par la suite. Le diméthylalloxane ainsi formé réagit au contact de l'ammoniaque pour former une molécule colorée, rouge pourpre, la muréxoïne, qui est un sel d'ammonium de tétraméthylmuréxide.
- L'enchaînement des réactions est présenté dans le schéma suivant :
7 Références
- ↑ Wikipédia - Caféine : http://fr.wikipedia.org/wiki/Caféine
- ↑ Marie Terrien, Josette Fournier, La chimie du petit déjeuner, Collection Formation (ISBN 2-9510168-5-9).
- ↑ Le Robert, dictionnaire.
Page réalisée avec l'aide de Vincent Escande et William Erb, et des informations partagées sur le forum de chimie.