Combustion du magnésium
Un article du site scienceamusante.net.
Très utilisé aussi en pyrotechnie pour la production de lumières très éclairantes ou de flash, la magnésium donne une combution même s'il n'est pas réduit en poudre contrairement à d'autres métaux (voir les étincelles).
1 Précautions
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
- Attention à la grande quantité de chaleur dégagée
 , il faut absolument tenir le ruban avec une pince et non avec les doigts.
, il faut absolument tenir le ruban avec une pince et non avec les doigts. - La lumière créée contient beaucoup de rayons ultraviolets
 , il faut se protéger les yeux à l'aide de lunettes de soleil efficaces (voir les ultraviolets).
, il faut se protéger les yeux à l'aide de lunettes de soleil efficaces (voir les ultraviolets).
2 Matériel
- Magnésium sous forme de ruban

- Bec Bunsen
- Pince en bois
- Lunette de soleil teintées et anti-UV
3 Protocole expérimental
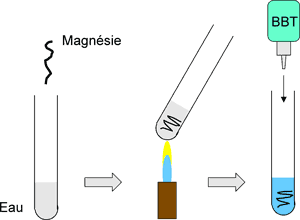
- Découper avec les mains 10 cm de ruban de magnésium, le tenir à l'aide d'une pince en bois et chauffer l'extrêmité avec la flamme du bec Bunsen.
- Après quelques secondes, le magnésium s'enflamme en dégageant une grande quantité de chaleur, de fumée blanche et de lumière blanche éblouissante (porter les lunettes de soleil).
4 Explications
- Le magnésium est un métal léger et assez mou et il réagit vivement avec le dioxygène O2
 contenu dans l'air lorsqu'on le chauffe, selon la réaction :
contenu dans l'air lorsqu'on le chauffe, selon la réaction :
- 2 Mg(s) + O2(g) → 2 MgO(s)
- Contrairement à ce que l'on pourrait penser, le magnésium, tout comme l'aluminium, possède un fort caractère réducteur et s'oxyde donc facilement en dégageant beaucoup de chaleur. C'est un bon combustible
 .
.
- La fumée blanche observée est de l'oxyde de magnésium MgO, encore appelée magnésie. (La magnésie utilisée par les escaladeurs en montagne ou les gymnastes qui s'en enduisent les mains est en réalité du carbonate de magnésium MgCO3. l'Oxyde de magnésium peut s'obtenir par calcination du carbonate de magnésium.). Mélangé à l'eau, cet oxyde de magnésium donne une solution alcaline (basique) ; d'autre part l'élément magnésium se trouve en grande quantité dans l'écorce terrestre ; c'est pour ces raisons que les éléments de la deuxième colonne du tableau périodique des éléments portent le nom d'alcalino-terreux.
- On peut d'ailleurs montrer ce caractère alcalin en recueillant les cendres dans une bécher contenant un peu d'eau. On fait bouillir l'eau et on y ajoute une goutte de bleu de bromothymol. La solution bleuit, signe qu'il s'est formé une base, l'hydroxyde de magnésium Mg(OH)2[1] :
- MgO(s) + H2O(l) → Mg(OH)2(aq)
- L'intense lumière produite lors de sa combustion en a fait un métal très utilisé dans les flashes photographiques. Les premiers photographes l'utilisaient sous forme de poudre afin que le flash soit encore plus vif et bref. La lumière produite provient de la grande chaleur produite par la combustion, c'est le rayonnement du corps noir expliqué dans les étincelles.
- Le magnésium est un si bon réducteur qu'il peut brûler dans le dioxyde de carbone CO2, qui n'est habituellement pas un bon oxydant. Cette réaction produit du carbone solide noir et de la magnésie MgO blanche :
- Mg(s) + CO2(g) → MgO(s) + C(s)
 Macrophotographie d'une combustion avec un temps d'exposition très court : on distingue les parties les plus chaudes du ruban (parties très blanches) où se produit l'oxydation (échappement de flocons blancs de MgO). © 2006 S. Querbes pour Anima-Science et Les atomes crochus. |
5 Références
- ↑ La caractère basique de la solution est aussi dû à la présence de Mg3N2 dans les cendres de magnésie, qui forment NH3 par réaction avec l'eau :
- Mg3N2(s) + 6 H2O(l) → 3 Mg(OH)2(aq) + 2 NH3(aq)